
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы окислит-восстанов реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Окисл-восстанреакции можно разделить на три типа: межмолекулярные, внутримолекулярные и реакции диспропорционирования (самоокисления - самовосстановления). Межмолекулярными наз окисл-восстан реакции, в рез кот изменстепень окисления атомов в разных веществах. Так обр, в роли окислителя и восстановителя в этом случае выступают разные вещества. Например:2Ca + O2 = 2CaOТакие окисл-восстано реакции встречаются чаще всего. Внутримолекулярными наз о кисл-восстан реак, в результате котменяется степень окисления разных атомов в одном и том же в-ве. В этом случае в роли окислителя и восстановителя выст разные атомы в одном и том же соединении. Например:2KClO3 = 2KCl + 3O2 Здесь хлор восстанавливается, а кислород окисляется. Реакциями диспропорционирования (дисмутации) наз окисл-восстан реакции, в ходе кот одновременно понижается и повыш степень окисления одного и того же элемента. В таких реакциях в роли окисл-ля и восст-ля выступают атомы одного и того же элемента. Например:4KClO3 = KCl + 3KClO4 Реакции диспропорционирования возможны, когда в исходном в-ве элемент имеет промежуточную степень окисления Окислит-восстан потенциалы Окисл-восстановпотенциалы определяют возможность и направленность протекания окисл-восстан реакций. 1. Пластинка активного металла Поскольку металл активен, катионы из пластинки переходят в раствор. Чем активнее металл, тем разность потенциалов выше. Активный малоактивный
Е<0 Е>0. Представим себе металлич пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверх пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается полож, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы. Наконец, наступает момент, когда между раствором и металлич пластинкой устанавл равновесие, которое можно выраз уравн:
или с учетом гидратации ионов в растворе:
При погружении металла в раствор на границе раздела фаз образ двойной электрический слой. Разность потенциалов, возник между металлом и окружего жидкой фазой, наз электродным потенциалом. Этот потенциал явл характерист окисл-восстан способности металла в виде твердой фазы.У изолированного металлич атома (состояние одноатомного пара, возникающее при выс темпер и высоких степенях разрежения) окислит-восстан с-ва характериздругой величиной, назионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.. Окисл-восстан св-ва воды В воде возможны протекания 2ух процессов:1. Восстановление ионов водородом или молекул воды:
2. Окисление гидроксид анионов или молекул воды:
Уравнение Нертнса для восстановления ионов в воде:
Если pH=7, то Это значит, что система с потенциалом меньшем чем -0,41В => не устойчива в воде. (вода выступает как восстановитель) Классификация дисперсных систем. По размеру: глубодисп - Среднедисперсные - Мелкодисперсные - По агрегатному состоянию:
Методы получ дисперсных систем. Дисперсионные методы: разл по способу измельчения – на коллоидных мельницах или электродиспергирования.На коллоидных мельницах в-во размельчают до размера коллоидных частиц. Метод встречных струй. Конденсационные методы. – на укрупнение частиц. -напыление -искровой разряд Замена раств-ля -реакция образ-я малораств-х соед-й. Строение коллоидной частицы. На примере Колло частица состоит из ядра мицеллы (AgI), след слой адсорбционный потенциалопределяющих ионов Ag; адсорбционный слой противоионов
Св-ва коллоидных систем. Молекулярно-кинетические св-ва. Молекулярно - кинетич наз св-ва, которые обусловлены хаотическим тепловым движ частиц. Применительно к коллоидным р-рам к этим св-вам следует отнести броуновское движение, диффузию и седиментацию. Броун движ — беспорядочное, хаотичное движ колл частиц.Диффузия - самопроизвольный процесс перемещения в-ва в результате беспорядочного тепл движчастиц,.Седиментация — распредел коллоидных частиц по высоте. В нижних слоях р-ра концентрация частиц дисперсной фазы значительно выше, чем в верхних..Отличител св-вом коллоидных систем явл их способность рассеивать свет. Коллоидные частицы обладают св-вом рассеивать во всех направлениях падающие на них лучи света
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 536; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.116 с.) |


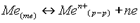

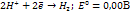





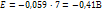
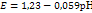 (при рН=7)
(при рН=7) 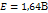
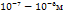

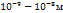
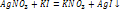
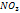 и диффузионный слой противоионов
и диффузионный слой противоионов 


