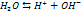Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Св-ва раст-ов слаб электролитов.Содержание книги
Поиск на нашем сайте
Для описания реальных св-в сильных электролитов вводят понятия эффект-й или кажущийся концентрации или активности Закон разбавлен Оствальда:
. Коэффиц диссоциации Диссоциация слабых кислот:
Диссоциация слабых оснований:
Растворимость веществ в воде. Мера растворимости – способн вещ-ва растворяться в воде при данных услов с образ насыщ р-ра. Насыщенный р-р – р-р, наход в равновесии с растворенным веществом при дан усл, содержащий макс кол-во растворенного в-ва. Концентрированный р-р – р-р, в кот находится более 20% растворенного в-ва. Растворимость зависит от: Природы растворяемого в-ва и растворителя, темп-ры, давления Правила: подобное растворяется в подобном; полярные в-ва раствоh в полярных растворителях, а неполярные – в неполярных растворителях. Закон Генри-Дальтона:
где Закон справедлив для нев-их давлениях, газ не должен образ-ть химич-их Соединений. Произведение растворимости Произв растворимости – количественный показатель степени нерастворимости солей и гидроксидов.
Если произведение концентрации ионов (ПК) будет меньше ПР, то раствор ненасыщенный и осадка нет. Если ПК больше ПР, то выпадает осадок и раствор перенасыщен. Если то раствор насыщен. Диссоциация воды. Вода является слабым электролитом. Диссоц воды - разлож воды на составляющие хим элементы,. Диссоциация воды явл эндотермической реакцией, т.е. идущей с поглощением теплоты из окруж среды.
При Ионное произведение воды Кw [Н2О] = [Н+] [ОН-] = 10-14 при 25°С – ионное произведение воды рН= -lg [H+] рОН= -lg [ОH-] рОН= 14 – рН [H+] = [ОH-], то рН=7 – среда нейтральная [H+] > [ОH-], то рН<7 – кислая среда Буферные р-ры и их свойства Буферные р-ры-это р-ры, рН которых ост-ся постояннвм при прибавлении небльшого кол-ва к-ты или щелочи. Св-ва буферных р-ов. 1.рН не зависит от разбавления..2. Конц-ия водор ионов буф р-ов мала изменяется от прибавления кислот и оснований.Но при добавл кислоты и основания следует помнить, что кол-во их не должно прев половины конц-ции соли или кислоты, образующих буфер. В противном случае емкость буфера будет превышена и рН может измениться. Буферные смеси играют большую роль в процессах, протекающих в живых организмах и в неживой природе. Буферная емкость- это кол-во моль к-ты или щелочи, которая необходима прибавить к 1л буф-го р-ра, чтобы изменить рН на 1. Гидролиз солей Гидролизом наз обменное разложение веществ с водой. Сущность гидролиза состоит в том, что катионы или анионы солей связсоответственно водородный или гидроксильный ионы воды с образ-ем малодиссоциирующих или труднораст продуктов. В этом процессе происх накапливание свободных ионов гидроксила или водорода Гидролизу подвержены соли слаб кислот и слаб оснований, слабых кислот и сильных оснований, сильных кислот и слабых оснований. Соли, образованные силь кислотой и силь основанием, гидролизу не подвергаются.Гидролиз протекает медленно, и равновесие устанавливаем через нек время. Этим объясняется изменение во времен рН растворов гидролитически расщепляемых солей. При гидролизе солей, образованн слаб основанием и сильн кислотой, константа гидролиза равна ионному произвед воды, деленному на константу диссоциации слабого основания: Кгидр = Кв/Кд,осн При гидролизе солей, образслабым основанием и слабой кислотой, константа гидролиза равна ионному произвед воды, деленному на произвед констант диссоциации основания и кислоты: Кгидр = Кв/Кд Косн Повышение темпер, усиливая диссоциацию воды, повышает конц-цию водородных и гидроксильных ионов. При гидролизе солей, образов слаб основанием и сильн кислотой или сильным основанием и слаб кислотой, в том же направлении влияет и пониж концентрации р-ра. Поэтому для усиления гидролиза следует.пользоваться более разбавленными р-рами и работать при более высокой темпер. Соль, образ сильной кислотой и слабым основанием, лучше гидролизуется при низкой конц-ции водородных ионов, а соль, образованная сильноснованием и слаб кислотой, наоборот при высоком содерж водородных ионов.
|
||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 248; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.121 (0.007 с.) |

 – для слабых электролитов
– для слабых электролитов зависит от природы растворителя и вещ-ва, а также от t (чем больше t, тем больше коэффициент диссоциации).
зависит от природы растворителя и вещ-ва, а также от t (чем больше t, тем больше коэффициент диссоциации). - I стадия
- I стадия
 - II стадия
- II стадия
 - I стадия
- I стадия
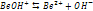 - II стадия
- II стадия

 – молярная доза вещества в насыще р-ре, k – постоянная Генри, p – порциальное давление газов.
– молярная доза вещества в насыще р-ре, k – постоянная Генри, p – порциальное давление газов.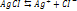


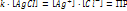
 – постоянная при данной температуре
– постоянная при данной температуре