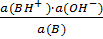Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические и концентрационные константы диссоциацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте У одноосновных кислот, растворённых в воде, устанавливается общее протолитическое равновесие: НА + Н2О ↔ Н3О+ + А- У сильных кислот это равновесие сильно сдвинуто вправо, у слабых кислот, наоборот, влево. Для слабых кислот это равновесие может быть охарактеризовано константой равновесия К = Вода в разбавленных растворах присутствует в огромных количествах, и её концентрация в процессе диссоциации практически неизменна. Поэтому а(Н2О) можно объединить с константой равновесия в новую константу Ка Ка = Так как мы пользовались активностями, мы получили истинную, или термодинамическую, константу диссоциации. Величина Ка называется константой кислотности. Значение константы кислотности характеризует силу кислоты и меру способности принимать участие в типичных для кислот реакциях. Она позволяет рассчитывать рН среды, электрическую проводимость раствора кислоты, а также служит мерой эффективности кислоты в реакциях кислотного катализа. И на все эти вопросы относительно поведения кислоты даёт ответ одна физическая постоянная. Например, значение Ка позволяет заключить, что хлоруксусная кислота в 80 раз сильнее уксусной. Чем сильнее кислота, тем больше Ка. Для удобства оценки силы кислоты, учитывая, что численные значения констант величины малые, часто применяют показатель константы р Ка. р Ка – это десятичный логарифм константы, взятый с обратным знаком, т.е. р Ка = -lg Ka. Если вместо активностей пользоваться концентрациями, то мы получим концентрационную константу диссоциации Кʹа. Эта константа зависит от ионной силы, и её можно определить экспериментально. Подобно кислотам, можно написать и для оснований В + Н2О ↔ ВН+ + ОН- Соответствующая константа диссоциации выразится как Кb = Кb – называют константой диссоциации основания. Выражение для концентрационной константы диссоциации можно записать в виде Kbʹ = Сила основания возрастает с ростом величины Кb и соответственно убывает с увеличением р Кb = -lg Кb. При близком значении относительных электроотрицательностей элемента Э и атома Н в гидроксидах Э(ОН)n возможна одновременная диссоциация по связям Э ─ О и О ─ Н. Следовательно, такие гидроксиды обладают одновременно и кислотными, и основными свойствами. Они амфотерны. Амфотерными свойствами обладает, например, НIО (относительная электроотрицательность йода равна 2,2, водорода 2,1): I+ + OH- ↔ HIO ↔ H+ + IO- pKb = 9,6 pKa = 10,6 Амфотерными свойствами обладают Ве(ОН)2, Al(OH)3, Cr(OH)3, а также ряд и других гидроксидов типичных элементов средней части периодической системы и переходных элементов. В соответствии с принципом Ле Шателье кислотные свойства амфотерных гидроксидов проявляются в их реакциях с основаниями, которые, связывая ионы ОН-, смещают равновесие вправо, и, наоборот, в кислой среде амфотерные гидроксиды ведут себя как основания, т.к. протоны кислоты связывают гидроксильные ионы: Э+ + ОН- ↔ ЭОН ↔ Н+ + ЭО- + + Н2О ← Н+ ОН- → Н2О
Буферные растворы С особым случаем влияния одинаковых ионов в растворе мы встречаемся в так называемых буферных растворах.
|
||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 1306; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.008 с.) |