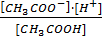Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние одноименного иона сильного электролита на процесс диссоциации слабого электролитаСтр 1 из 7Следующая ⇒
Сильные электролиты Экспериментальное определение степени диссоциации сильных электролитов приводит к заниженным результатам α по сравнению с теоретически рассчитанным значениям, которые вычисляли, допуская, что у сильных электролитов диссоциация проходит полностью. Полученные экспериментальные значения α получили название кажущейся степени диссоциации. (Кажущаяся степень диссоциации сильного электролита обычно определялась по измерению электрической проводимости раствора). Значения кажущейся степени диссоциации были всегда ниже истинной степени диссоциации. Этот факт требовал объяснения. Так как сильные электролиты в растворах практически полностью диссоциированы на ионы, то нельзя пренебрегать взаимодействием между ионами. Теория сильных электролитов (Дебай и Хюккель, 1923) объяснила это явление. Согласно положениям теории, нужно учитывать совокупность взаимодействия каждого данного иона со всеми остальными окружающими его ионами того и другого знака заряда. Одноимённо заряженные ионы взаимно отталкиваются, а разноимённо заряженные – взаимно притягиваются, поэтому каждый ион в растворе окружается ближе к нему расположенными ионами противоположного знака заряда. Таким образом, каждый ион окружается как бы роем ионов (ионной атмосферой). При этом каждый из ионов, составляющих ионную атмосферу, очевидно, сам в свою очередь является центром ионной атмосферы, окружающей его. В результате проявляется тенденция к более или менее закономерному размещению ионов по всему объёму раствора. Размещение это в известной степени аналогично размещению ионов в соответствующих ионных кристаллах, но отличается прежде всего большим расстоянием между ионами и присутствием растворителя. Молекулы растворителя не только находятся в пространстве между ионами, но и взаимодействуют с ними, образуя сольваты; это отражается на свойствах как самих ионов, так и молекул растворителя. Конечно, тепловое движение частиц в той или иной степени нарушает указанную закономерность в расположении ионов. Пренебрегать взаимодействием между ионами в растворах сильных электролитов, особенно с увеличением концентрации раствора, нельзя. Электростатическое взаимодействие в сильной степени зависит от зарядов ионов, концентрации электролита, диэлектрической проницаемости среды и ряда других факторов. С уменьшением заряда ионов и концентрации электролита это взаимодействие ослабевает. В этом же направлении действует увеличении диэлектрической проницаемости. Следует отметить, что увеличение электростатического взаимодействия между ионами за счёт повышения концентрации электролитов приводит к кажущемуся уменьшению степени электролитической диссоциации сильного электролита. Сказанное подтверждается рядом экспериментальных опытов, проведённых с растворами сильных электролитов.
Например, степень электролитической диссоциации, вычисленная из данных по электропроводности растворов λ сильных электролитов при конечной их концентрации и бесконечном разведении λ∞, оказывается меньше единицы; её называют кажущейся степенью диссоциации (α каж) αкаж = Нужно помнить, что αкаж вовсе не характеризует истинной степени диссоциации (истинная степень диссоциации всегда близка к единице). Ионы в растворах не так уж свободны и независимы друг от друга. Электропроводность при некоторой конкретной концентрации соответствует как бы меньшему числу ионов, чем это следовало бы при полной диссоциации. Однако такое кажущееся уменьшение числа ионов объясняется не соединением их в молекулы, а тем, что каждый ион окружен как бы атмосферой из противоположно заряженных ионов, которые тормозят движение данного иона к электроду, имеющему противоположный заряд, при измерении электропроводности. Для растворов сильных электролитов характерно ещё и то, что даже в разбавленных растворах Кα дисс ≠ Кс дисс, поэтому для растворов сильных электролитов важное значение имеет активность (а) электролита. Активность отражает действительное состояние ионов в растворе, учитывая взаимодействие ионов с другими частицами (молекулами растворителя, ионами). Активность (а) и концентрация электролита (с) связаны соотношением а = f ∙ c где f – коэффициент активности. Активность всегда меньше расчётной концентрации ионов, т.е. f < 1; при большом разбавлении значение активности можно принять равным концентрации иона, т.е. при разбавлении раствора f → 1, а → с. Для большинства электролитов типа А+Х- коэффициент активности изменяется при разбавлении от f ≈ 0,8 (c = 0,1 моль/л) до f ≈ 96 (c = 0,001 моль/л).
Другой количественной характеристикой растворов сильных электролитов является ионность среды µ. В литературе обычно эту величину называют ионной силой раствора. Ионная сила раствора учитывает взаимодействие всех находящихся в растворе ионов. Она позволяет судить об активности того или иного иона. Под ионной силой среды понимают меру электростатического взаимодействия между всеми ионами раствора. Если наряду с ионами данного электролита в растворе присутствуют также ионы второго электролита, то интенсивность общего электрического поля будет складываться из интенсивности полей обоих электролитов. Теория показывает, что вклад каждого сорта ионов пропорционален концентрации ионов и квадрату их зарядов, причём коэффициент пропорциональности равен ½. Таким образом, ионная сила раствора определяется следующим выражением: µ = ½(с1∙ z12 + c2∙ z22 + с3∙ z32 + cnzn2) где с – моляльнаяконцентрация иона; z – его заряд. Оказалось, что коэффициент активности для данного иона одинаков для всех растворов с одинаковой ионной силой и приблизительно одинаковый заряд. Для очень разбавленных растворов электролитов f ≈1. Для очень разбавленных растворов, ионная сила которых µ≤ 0,01, коэффициент активности данного иона может быть определён по формуле lg f = - 0,5z2 Коэффициент 0,5 действителен для водных растворов при температуре 200С. В растворах со средним разбавлением 0,5 > µ > 0,01 коэффициент активности определяется по формуле lg f = - Наконец, в ещё более концентрированных растворах коэффициент активности следует рассчитывать по более сложной формуле lg f = - где а – радиус данного иона, см; А – эмпирический коэффициент, зависящий от природы растворённого электролита и растворителя. Таким образом, коэффициент активности, а значит и активность данного иона, определяется величиной заряда этого иона и зависит от ионной силы раствора в целом. В качестве примера вычислим активность ионов Al3+ и SO42- в 0,005 М водном н/растворе соли Al2(SO4)3. Так как эта соль сильный электролит, молярная концентрация ионов алюминия с (Al3+) = 2∙0?005 = 0,01 моль-ион/л, а сульфат-иона с (SO42-) = 3∙0,005 = 0,015 моль-ион/л. Ионная сила этого раствора равна µ = 0,5(0,01∙32 + 0,015∙22) = 0,075. Коэффициент активности ионов f в этом случае вычисляется по формуле lg f (Al) = a (Al3+) = 0,01∙ 0,11 = 0,0011моль-ион/л = 1,1∙10-3 моль-ион/л lg f (SO4) = a (SO42-) = 0,015 ∙ 0,37 = 0,00555 = 5,55∙10-3 моль-ион/л Отметим, что ионная сила – свойство раствора, связанное и с концентрацией, и с природой (т.е. с величиной заряда) ионов. Клеточная активность зависит от обоих факторов. В общем случае при исследовании клеток работают при ионной силе раствора равной ~ 0,15. Это значение обычно называют оптимальной физиологической ионной силой. Такая ионная сила считается оптимальной, поскольку при этих условиях поддерживается нормальный водный баланс в живой клетке. Ведь с неповреждёнными клетками, помещёнными в раствор, в котором концентрация солей (ионов) даже приблизительно не соответствует их концентрации во внутриклеточной жидкости (протоплазме), может произойти одно из двух нежелательных событий. Если ионная сила внеклеточной жидкости много меньше, чем что ионная сила протоплазмы, вода начинает поступать в клетку, так что клетка набухает и затем лопается. Напротив, если ионная сила внеклеточной жидкости намного больше, чем ионная сила протоплазмы, вода начинает уходить из клетки, клетка сморщивается и сжимается. В первом случае клетка обводняется, а в другом – дегидратируется (теряет воду), но в любом из этих случаев - клетка погибает.
Внутривенное введение стерильного солевого раствора (0,9%-ный раствор NaCl с µ = 0,154 М) – обычная процедура в медицинской практике для лечения обезвоживания, предотвращения послеоперационного шока и возмещения потери жидкости при кровотечении. Это не вызывает разрушения эритроцитов, поскольку 0,9%-ный раствор хлорида натрия является изотоническим относительно крови (т.е. имеет ту же самую концентрацию соли и, следовательно, то же осмотическое давление, что и кровь). Для указанных целей можно использовать также 5,5%-ный раствор глюкозы. Установлено, что закон действующих масс приложим ко всем электролитам, если в соответствующих уравнениях вводить не величины стехиометрических молярных или моль-ионных концентраций, а величины эффективных концентраций или активностей. Например, для электролита МеА↔Ме+ + А- константа диссоциации равна: К = В растворах с небольшой ионной силой можно считать: f (MeA) = 1. Поэтому Ка = К∙f(Ме)∙f(A) где Ка – константа активности, К – константа диссоциации. Следует подчеркнуть, что понятие активности ионов или молекул не условное представление; оно отражает реальное количество частиц в единице объёма системы, принимающих участие в большинстве фихико-химических процессов.
Растворы сильных кислот К сильным кислотам относятся Галогеноводородные (HCl, HBr, HI), азотная, серная, хлорная (HClO) и хлорноватая (НClO3) кислоты. Диссоциация одноосновной сильной кислоты НА может быть выражена схемой НА ↔ Н+ + А-. Так как кислота сильная и в растворе она диссоциирует практически полностью, то активность ионов водорода равна а (Н+) = с(НА)∙ f (H) где с(НА) – молярная концентрация кислоты, f (H) – коэффициент активности ионов водорода. При f (H) = 1 (в случае большого разбавления раствора электролита) ИМЕЕМ:
а (Н+) = с(НА) = [H+] Пример Определить концентрацию ионов водорода в 0,01 Н растворе HCl. Решение Так как с(НCl) = 0,01 и кислота практически полностью диссоциирована, µ= 0,01, а f (H) = 0,89 (данные берут из справочника), то а (Н+) = 0,01∙0,89 = 0,0089 моль/л = 8,9 ∙ 10-3 моль/л Растворы слабых кислот Пусть мы имеем раствор одноосновной слабой кислоты концентрации с. Обозначим концентрацию диссоциированных молекул слабой одноосновной кислоты через х, получим: [H+] = x и [OH-] = x так как для одноосновной кислоты [H+] = [OH-]; концентрация недиссоциированных молекул [HA] = с – х. В случае очень слабой кислоты концентрация диссоциированных молекул весьма незначительна по сравнению с общей концентрацией её, и величину с – х можно принять равной величине с (НА). Следовательно, согласно закону разбавления Оствальда, можно записать следующее: К НА = Откуда х = и [H+] = Логарифмируя это уравнение, получим: lg[H+] = ½lg K (HA) + ½lg c (HA) или рН = ½р К (НА) - ½lg c (HA) Пример Вычислить концентрацию ионов водорода и степень диссоциации 0,1 Н раствора СН3СООН, константа диссоциации которой К = 1,8∙10-5. Решение По формуле рН = ½р К (НА) - ½lg c (HA) находим: рН = 2,37 + 0,5 = 2,87 и [H+] = = 1,35∙10-3 моль/л α = По приведённым формулам вычислять концентрации ионов водорода можно, когда величина концентрации кислоты превышает больше чем в 1000 раз величину константы диссоциации, т.е. когда с (НА) ≥ 1000 К (НА). П Р И М Е Р Вычислить рН 0,1 н раствора синильной кислоты (HCN), если степень диссоциации равна 0,007% или 7∙10-5. Решение: [H+] = Cα =0,1∙7∙10-5 = 7∙10-6 Далее находим рН: рН = -lg7∙10-6 = 6 – lg7 = 6 – 0,85 = 5,15 В растворах сильных электролитов активность ионов, как указывалось выше, меньше их истинной концентрации. Для определения рН раствора сильной кислоты или сильного основания необходимо использовать не концентрации, а активности ионов водорода (
П Р И М Е Р 5 Вычислить рН 0,02 М раствора хлороводородной кислоты (HCl). Решение: Вычисляем ионную силу раствора: µ =½(0,02∙12 + 0,02∙12) = 0,02. Коэффициент активности при этой ионной силе равен 0,91. Тогда Отсюда рН = -lg (Укажем, что без учёта ионной силы рН = -lg0,02 = 1,70. Относительная погрешность вычисления составит 2,3%).
Пример Определите водородный показатель рН в 0,006М растворе серной кислоты при 250С. Решение H2SO4 + 2H2O = SO42- + 2H3O+; рН< 7 pH = -lg[H3O+] = -lg(2∙0,006] = 1,92 Ответ: 0,006М раствор H2SO4 имеет рН 1,92 Пример Определите рН в 0,012М растворе гидроксида бария при 250С. Решение Ва(ОН)2 = Ва2+ + 2ОН-, рН > 7 рН = 14 – рОН = 14 + lg(2∙0,012) = 12,38 Ответ: 0,012М раствор Ва(ОН)2 имеет рН 12,38 Пример Концентрация ионов водорода в водном растворе равна 2∙10-3 моль-ион/л. Требуется вычислить концентрацию ионов гидроксила. Решение [OH-] = Пример рН = 5,3; вычислить концентрацию ионов водорода. Решение
рН = 5,3 = 6 – 0,7, т.е. lg[H+] =
Теория кислот и оснований Дорога к познанию кислот была открыта теорией электролитической диссоциации Аррениуса. Представление о процессе ионизации позволило Аррениусу создать модель кислоты, которая была первым приближением к современным взглядам на кислоты и основания. Согласно модели Аррениуса, кислота есть всякое водородсодержащее соединение, которое в водном растворе образует ионы водорода, а основание есть всякое гидроксилсодержащее соединение, которое в водном растворе образует ионы гидроксила. Процесс нейтрализации кислоты основанием изображается посредством реакции Н+ + ОН- = Н2О. Благодаря теории Аррениуса стали понятны многие стороны поведения кислот и оснований и впервые были найдены количественные соотношения. Так, стала понятной постоянная теплота нейтрализации сильной кислоты сильным основанием и другие экспериментальные факты. Хотя химики и пришли к мысли, что кислоты – это соединения, содержащие водород, они ещё не были убеждены в том, что основания должны содержать гидроксильные группы. Было известно, что многие органические соединения, а также аммиак проявляют в реакциях основные свойства, но гидроксильных групп не содержат и игнорировать это было трудно. Поэтому учёные работали над созданием новых теорий кислот и оснований.
Буферные растворы С особым случаем влияния одинаковых ионов в растворе мы встречаемся в так называемых буферных растворах. Белковые буферные системы Белковые буферные системы являются амфолитными, так как они способны присоединять или отщеплять протоны вследствие присутствия в белках групп с кислотными свойствами (-СООН и -NH3+) и основными свойствами (-СОО- и -NH2). Механизм действия такой буферной системы можно представить следующим образом. Кислотная буферная система: а) H3N+ ─ R ─ COOH + OH- ↔ H2N ─ R ─ COO- + H2O Белок – кислота б) H3N+ ─ R ─ COO- + H+ ↔ H3N+ ─ R ─ COOH Соль белка – Кислоты (сопряженное основание) Основная буферная система: а) H2N ─ R ─ COO- + H+ ↔ H3N+ ─ R ─ COO- Белок – основание б) H3N+ ─ R ─ COO- + ОН- ↔ H2N ─ R ─ COO- + H2O Соль белка – Основания (сопряженная кислота)
где R – макромолекулярный остаток белка. Роль белков плазмы крови в гомеостазе ионов водорода весьма мала.
Гемоглобиновая буферная система является сложной буферной системой эритроцитов, которая включает в качестве донора протона две слабые кислоты: гемоглобин ННb и оксигемоглобин ННbO2. Роль акцептора протона играют сопряженные этим кислотам основания, т.е. их анионы Hb1- и HbO21-. Механизм буферного действия этой системы основан на следующих реакциях:
H+ + Hb- ↔ HHb pKa(HHb) = 8,20
H+ + HbO21- ↔ ННbO2 ↔ HHb + O2 pKa(HHbO2) = 6,95
При добавлении кислот поглощать ионы Н+ в первую очередь будут анионы гемоглобина, которые имеют большое сродство к протону. При действии основания оксигемоглобин будет проявлять большую активность, чем гемоглобин:
ОН- + ННbO2 ↔ HbO2- + H2O ОН- + ННb ↔ Hb- + H2O
Таким образом, гемоглобиновая система крови играет значительную роль сразу в нескольких важнейших физиологических процессах организма: дыхании, транспорте кислорода в ткани и поддержании постоянства рН внутри эритроцитов, а в конечном итоге – в крови. Эта система эффективно функционирует только в сочетании с другими буферными системами крови.
Сильные электролиты Экспериментальное определение степени диссоциации сильных электролитов приводит к заниженным результатам α по сравнению с теоретически рассчитанным значениям, которые вычисляли, допуская, что у сильных электролитов диссоциация проходит полностью. Полученные экспериментальные значения α получили название кажущейся степени диссоциации. (Кажущаяся степень диссоциации сильного электролита обычно определялась по измерению электрической проводимости раствора). Значения кажущейся степени диссоциации были всегда ниже истинной степени диссоциации. Этот факт требовал объяснения. Так как сильные электролиты в растворах практически полностью диссоциированы на ионы, то нельзя пренебрегать взаимодействием между ионами. Теория сильных электролитов (Дебай и Хюккель, 1923) объяснила это явление. Согласно положениям теории, нужно учитывать совокупность взаимодействия каждого данного иона со всеми остальными окружающими его ионами того и другого знака заряда. Одноимённо заряженные ионы взаимно отталкиваются, а разноимённо заряженные – взаимно притягиваются, поэтому каждый ион в растворе окружается ближе к нему расположенными ионами противоположного знака заряда. Таким образом, каждый ион окружается как бы роем ионов (ионной атмосферой). При этом каждый из ионов, составляющих ионную атмосферу, очевидно, сам в свою очередь является центром ионной атмосферы, окружающей его. В результате проявляется тенденция к более или менее закономерному размещению ионов по всему объёму раствора. Размещение это в известной степени аналогично размещению ионов в соответствующих ионных кристаллах, но отличается прежде всего большим расстоянием между ионами и присутствием растворителя. Молекулы растворителя не только находятся в пространстве между ионами, но и взаимодействуют с ними, образуя сольваты; это отражается на свойствах как самих ионов, так и молекул растворителя. Конечно, тепловое движение частиц в той или иной степени нарушает указанную закономерность в расположении ионов. Пренебрегать взаимодействием между ионами в растворах сильных электролитов, особенно с увеличением концентрации раствора, нельзя. Электростатическое взаимодействие в сильной степени зависит от зарядов ионов, концентрации электролита, диэлектрической проницаемости среды и ряда других факторов. С уменьшением заряда ионов и концентрации электролита это взаимодействие ослабевает. В этом же направлении действует увеличении диэлектрической проницаемости. Следует отметить, что увеличение электростатического взаимодействия между ионами за счёт повышения концентрации электролитов приводит к кажущемуся уменьшению степени электролитической диссоциации сильного электролита. Сказанное подтверждается рядом экспериментальных опытов, проведённых с растворами сильных электролитов. Например, степень электролитической диссоциации, вычисленная из данных по электропроводности растворов λ сильных электролитов при конечной их концентрации и бесконечном разведении λ∞, оказывается меньше единицы; её называют кажущейся степенью диссоциации (α каж) αкаж = Нужно помнить, что αкаж вовсе не характеризует истинной степени диссоциации (истинная степень диссоциации всегда близка к единице). Ионы в растворах не так уж свободны и независимы друг от друга. Электропроводность при некоторой конкретной концентрации соответствует как бы меньшему числу ионов, чем это следовало бы при полной диссоциации. Однако такое кажущееся уменьшение числа ионов объясняется не соединением их в молекулы, а тем, что каждый ион окружен как бы атмосферой из противоположно заряженных ионов, которые тормозят движение данного иона к электроду, имеющему противоположный заряд, при измерении электропроводности. Для растворов сильных электролитов характерно ещё и то, что даже в разбавленных растворах Кα дисс ≠ Кс дисс, поэтому для растворов сильных электролитов важное значение имеет активность (а) электролита. Активность отражает действительное состояние ионов в растворе, учитывая взаимодействие ионов с другими частицами (молекулами растворителя, ионами). Активность (а) и концентрация электролита (с) связаны соотношением а = f ∙ c где f – коэффициент активности. Активность всегда меньше расчётной концентрации ионов, т.е. f < 1; при большом разбавлении значение активности можно принять равным концентрации иона, т.е. при разбавлении раствора f → 1, а → с. Для большинства электролитов типа А+Х- коэффициент активности изменяется при разбавлении от f ≈ 0,8 (c = 0,1 моль/л) до f ≈ 96 (c = 0,001 моль/л). Другой количественной характеристикой растворов сильных электролитов является ионность среды µ. В литературе обычно эту величину называют ионной силой раствора. Ионная сила раствора учитывает взаимодействие всех находящихся в растворе ионов. Она позволяет судить об активности того или иного иона. Под ионной силой среды понимают меру электростатического взаимодействия между всеми ионами раствора. Если наряду с ионами данного электролита в растворе присутствуют также ионы второго электролита, то интенсивность общего электрического поля будет складываться из интенсивности полей обоих электролитов. Теория показывает, что вклад каждого сорта ионов пропорционален концентрации ионов и квадрату их зарядов, причём коэффициент пропорциональности равен ½. Таким образом, ионная сила раствора определяется следующим выражением: µ = ½(с1∙ z12 + c2∙ z22 + с3∙ z32 + cnzn2) где с – моляльнаяконцентрация иона; z – его заряд. Оказалось, что коэффициент активности для данного иона одинаков для всех растворов с одинаковой ионной силой и приблизительно одинаковый заряд. Для очень разбавленных растворов электролитов f ≈1. Для очень разбавленных растворов, ионная сила которых µ≤ 0,01, коэффициент активности данного иона может быть определён по формуле lg f = - 0,5z2 Коэффициент 0,5 действителен для водных растворов при температуре 200С. В растворах со средним разбавлением 0,5 > µ > 0,01 коэффициент активности определяется по формуле lg f = - Наконец, в ещё более концентрированных растворах коэффициент активности следует рассчитывать по более сложной формуле lg f = - где а – радиус данного иона, см; А – эмпирический коэффициент, зависящий от природы растворённого электролита и растворителя. Таким образом, коэффициент активности, а значит и активность данного иона, определяется величиной заряда этого иона и зависит от ионной силы раствора в целом. В качестве примера вычислим активность ионов Al3+ и SO42- в 0,005 М водном н/растворе соли Al2(SO4)3. Так как эта соль сильный электролит, молярная концентрация ионов алюминия с (Al3+) = 2∙0?005 = 0,01 моль-ион/л, а сульфат-иона с (SO42-) = 3∙0,005 = 0,015 моль-ион/л. Ионная сила этого раствора равна µ = 0,5(0,01∙32 + 0,015∙22) = 0,075. Коэффициент активности ионов f в этом случае вычисляется по формуле lg f (Al) = a (Al3+) = 0,01∙ 0,11 = 0,0011моль-ион/л = 1,1∙10-3 моль-ион/л lg f (SO4) = a (SO42-) = 0,015 ∙ 0,37 = 0,00555 = 5,55∙10-3 моль-ион/л Отметим, что ионная сила – свойство раствора, связанное и с концентрацией, и с природой (т.е. с величиной заряда) ионов. Клеточная активность зависит от обоих факторов. В общем случае при исследовании клеток работают при ионной силе раствора равной ~ 0,15. Это значение обычно называют оптимальной физиологической ионной силой. Такая ионная сила считается оптимальной, поскольку при этих условиях поддерживается нормальный водный баланс в живой клетке. Ведь с неповреждёнными клетками, помещёнными в раствор, в котором концентрация солей (ионов) даже приблизительно не соответствует их концентрации во внутриклеточной жидкости (протоплазме), может произойти одно из двух нежелательных событий. Если ионная сила внеклеточной жидкости много меньше, чем что ионная сила протоплазмы, вода начинает поступать в клетку, так что клетка набухает и затем лопается. Напротив, если ионная сила внеклеточной жидкости намного больше, чем ионная сила протоплазмы, вода начинает уходить из клетки, клетка сморщивается и сжимается. В первом случае клетка обводняется, а в другом – дегидратируется (теряет воду), но в любом из этих случаев - клетка погибает. Внутривенное введение стерильного солевого раствора (0,9%-ный раствор NaCl с µ = 0,154 М) – обычная процедура в медицинской практике для лечения обезвоживания, предотвращения послеоперационного шока и возмещения потери жидкости при кровотечении. Это не вызывает разрушения эритроцитов, поскольку 0,9%-ный раствор хлорида натрия является изотоническим относительно крови (т.е. имеет ту же самую концентрацию соли и, следовательно, то же осмотическое давление, что и кровь). Для указанных целей можно использовать также 5,5%-ный раствор глюкозы. Установлено, что закон действующих масс приложим ко всем электролитам, если в соответствующих уравнениях вводить не величины стехиометрических молярных или моль-ионных концентраций, а величины эффективных концентраций или активностей. Например, для электролита МеА↔Ме+ + А- константа диссоциации равна: К = В растворах с небольшой ионной силой можно считать: f (MeA) = 1. Поэтому Ка = К∙f(Ме)∙f(A) где Ка – константа активности, К – константа диссоциации. Следует подчеркнуть, что понятие активности ионов или молекул не условное представление; оно отражает реальное количество частиц в единице объёма системы, принимающих участие в большинстве фихико-химических процессов.
Влияние одноименного иона сильного электролита на процесс диссоциации слабого электролита Что произойдёт, если к раствору слабого электролита прибавить другой, сильный электролит, содержащий один из ионов, образующихся при диссоциации слабого электролита? Например, если к раствору уксусной кислоты (слабый электролит) прибавить раствор ацетата калия (сильный электролит), то в растворе резко увеличится концентрация ионов СН3СОО- и чтобы при этом величина К =
осталась постоянной, должна возрасти концентрация недиссоциированной уксусной кислоты или должны уменьшится концентрации ионов Н+ и СН3СОО¯. И то, и другое произойдёт, если часть ионов Н+ и СН3СОО¯ образует молекулы СН3СООН. Соответственно, степень диссоциации СН3СООН уменьшится. Этот пример показывает, что
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 728; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.251.72 (0.108 с.) |
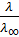
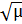
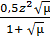
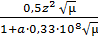 + A
+ A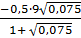 = - 0,967 =
= - 0,967 = 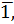 033 и f (Al) = 0,11
033 и f (Al) = 0,11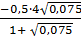 = - 0,430 =
= - 0,430 = 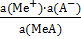 =
= 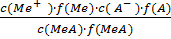


 = 1,35∙10-2 или 1,35%
= 1,35∙10-2 или 1,35% ) и гидроксила (
) и гидроксила ( ):
): = 5∙10-12 моль-ион/л, или рН = 3 – lg2 = 2,7 и рОН = 11,3
= 5∙10-12 моль-ион/л, или рН = 3 – lg2 = 2,7 и рОН = 11,3 ,7 и [H+] = 5∙10-6 моль-ион/л
,7 и [H+] = 5∙10-6 моль-ион/л