
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы вычисления значений рН слабых кислот и оснований
Для вычисления значений рН слабых кислот и оснований необходимо знать концентрацию раствора и константу диссоциации кислоты или основания. Справедливо и обратное утверждение: если известно значение рН раствора, то можно найти константу диссоциации слабого электролита. Пример. Вычислите значение рН раствора масляной кислоты концентрации 1,00∙10-2 моль∙л-3, значение Ка которой равно 1,51∙10-5 моль∙л-3. Решение. Воспользуемся уравнением: Ка = Концентрации [H3O+] и [C3H7CO2-] равны. Концентрация [C3H7CO2H] значительно меньше, чем 1,00∙10-2 моль∙л-3. Так как степень ионизации мала, то допущение, что [C3H7CO2H] = 1,00∙10-2 моль∙л-3, упрощает выражение. Итак: [H3O+]2 = 1,51∙10-5∙1,00∙10-2; [H3O+] = 3,89∙10-4 моль∙л-3; рН = 3,42 Насколько справедливо допущение: [C3H7CO2H] = 1,00∙10-2 моль∙л-3? Так как (приблизительно) [H3O+] = 1,00∙10-2 моль∙л-3, то: [C3H7CO2H] = (1,00∙10-2) – (3,89∙10-4) = 0,96∙10-2 моль∙л-3. Если воспользоваться этим приближенным значением для повторного расчёта, то получим значение рН = 3,42, т.е. такое же, что и в первом случае; иными словами, сделанное допущение справедливо. Для большинства слабых кислот и оснований подобное приближение оправдано. Пример. Значение рН раствора диметиламина концентрации 1,00∙10-2 моль∙л-3 при 250С равно 7,64. Вычислите константу диссоциации (α) и степень диссоциации основания.
(СН3)2NH +H2O ↔ (СН3)2NH2+ OH- Тогда: Kb = [(CH3)2NH2+]∙[OH-] / [(CH3)2NH] = [OH-]2 / (1,00 ∙ 10-2). И далее: рН = 7,64; рОН = 14,0 – 7,64 = 6,36 (250С) [OH-] = antilg(-6,36) = 4,37∙10-7 моль/л Kb = (4,37∙10-7)2 / (1,00 ∙ 10-2) = 1,91∙ 10-11 моль/л Воспользуемся для степени диссоциации α уравнением закона разведения Оствальда: Kb =α2c / (1 – α). Для слабого основания Kb = α2c; 1,91∙ 10-11 = α2∙ 1,00 ∙ 10-2; α = 4,37∙10-5. Пример Определите водородный показатель рН в 0,006М растворе серной кислоты при 250С. Решение H2SO4 + 2H2O = SO42- + 2H3O+; рН< 7 pH = -lg[H3O+] = -lg(2∙0,006] = 1,92 Ответ: 0,006М раствор H2SO4 имеет рН 1,92 Пример Определите рН в 0,012М растворе гидроксида бария при 250С. Решение Ва(ОН)2 = Ва2+ + 2ОН-, рН > 7 рН = 14 – рОН = 14 + lg(2∙0,012) = 12,38 Ответ: 0,012М раствор Ва(ОН)2 имеет рН 12,38 Пример Концентрация ионов водорода в водном растворе равна 2∙10-3 моль-ион/л. Требуется вычислить концентрацию ионов гидроксила. Решение [OH-] =
Пример рН = 5,3; вычислить концентрацию ионов водорода. Решение рН = 5,3 = 6 – 0,7, т.е. lg[H+] =
Теория кислот и оснований Дорога к познанию кислот была открыта теорией электролитической диссоциации Аррениуса. Представление о процессе ионизации позволило Аррениусу создать модель кислоты, которая была первым приближением к современным взглядам на кислоты и основания. Согласно модели Аррениуса, кислота есть всякое водородсодержащее соединение, которое в водном растворе образует ионы водорода, а основание есть всякое гидроксилсодержащее соединение, которое в водном растворе образует ионы гидроксила. Процесс нейтрализации кислоты основанием изображается посредством реакции Н+ + ОН- = Н2О. Благодаря теории Аррениуса стали понятны многие стороны поведения кислот и оснований и впервые были найдены количественные соотношения. Так, стала понятной постоянная теплота нейтрализации сильной кислоты сильным основанием и другие экспериментальные факты. Хотя химики и пришли к мысли, что кислоты – это соединения, содержащие водород, они ещё не были убеждены в том, что основания должны содержать гидроксильные группы. Было известно, что многие органические соединения, а также аммиак проявляют в реакциях основные свойства, но гидроксильных групп не содержат и игнорировать это было трудно. Поэтому учёные работали над созданием новых теорий кислот и оснований.
|
|||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.7.85 (0.005 с.) |
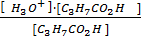
 = 5∙10-12 моль-ион/л, или рН = 3 – lg2 = 2,7 и рОН = 11,3
= 5∙10-12 моль-ион/л, или рН = 3 – lg2 = 2,7 и рОН = 11,3 ,7 и [H+] = 5∙10-6 моль-ион/л
,7 и [H+] = 5∙10-6 моль-ион/л


