
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа): и изохоры химической реакции (изохоры Вант-Гоффа): 26.Принцип Ле-Шателье. С конкретными примерами. При неизменных условиях химическое равновесие в системе может сохраняться сколь угодно долго. В случае же изменения условий (концентрация, температура, давление) одна из противоположно направленных реакций может ускориться. После этого равновесие сместится, и установится новое состояние равновесия. Принцип Ле-Шателье: если на систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия. 1. Влияние температуры. Повышение температуры смещает равновесие в сторону процесса, идущего с поглощением тепла: 2SO2+O2 → 2SO3+Q
|
||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 403; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.113.188 (0.004 с.) |

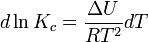 Здесь ∆H и ∆U − тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если тепловой эффект положителен (реакция эндотермическая), то температурный коэффициент константы равновесия тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом ЛеШателье).При изотермических реакциях T – const.
Здесь ∆H и ∆U − тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если тепловой эффект положителен (реакция эндотермическая), то температурный коэффициент константы равновесия тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом ЛеШателье).При изотермических реакциях T – const. 2. Влияние концентрации.При увеличении концентрации исходных веществ равновесие смещается в сторону реакции, потребляющей эти вещества (вправо): 2SO2+O2 → 2SO3 3. Влияние давления. Увеличение давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления. Примечание. На реакцию, идущую без изменения числа молей, давление не влияет. 2SO2+O2 → 2SO3
2. Влияние концентрации.При увеличении концентрации исходных веществ равновесие смещается в сторону реакции, потребляющей эти вещества (вправо): 2SO2+O2 → 2SO3 3. Влияние давления. Увеличение давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления. Примечание. На реакцию, идущую без изменения числа молей, давление не влияет. 2SO2+O2 → 2SO3  Действие принципа ЛеШателье можно проследить на примере изменения химического состава дождя или растворения шипучей антацидной (снижающей кислотность желудочного сока) таблетки в воде. В обоих случаях в химической реакции участвуют углекислый газ (CO2), вода(H2O) и угольная кислота (H2CO3):CO2 + H2O <—> H2CO3Когда дождевая капля попадает в воздух, она поглощает углекислый газ, и концентрация в левой части реакции возрастает. Для поддержания равновесия образуется большее количество угольной кислоты. В результате дождь становится кислотным. Добавление углекислого газа смещает равновесие реакции вправо. Противоположная реакция происходит при опускании в воду таблетки антацида (вещества, нейтрализующего кислоту). Бикарбонат натрия (антацид) вступает в реакцию с водой, и образуется угольная кислота, что приводит к увеличению концентрации вещества в правой части реакции. Чтобы восстановилось равновесие, угольная кислота разлагается на воду и углекислый газ, который мы и наблюдаем в виде пузырьков.
Действие принципа ЛеШателье можно проследить на примере изменения химического состава дождя или растворения шипучей антацидной (снижающей кислотность желудочного сока) таблетки в воде. В обоих случаях в химической реакции участвуют углекислый газ (CO2), вода(H2O) и угольная кислота (H2CO3):CO2 + H2O <—> H2CO3Когда дождевая капля попадает в воздух, она поглощает углекислый газ, и концентрация в левой части реакции возрастает. Для поддержания равновесия образуется большее количество угольной кислоты. В результате дождь становится кислотным. Добавление углекислого газа смещает равновесие реакции вправо. Противоположная реакция происходит при опускании в воду таблетки антацида (вещества, нейтрализующего кислоту). Бикарбонат натрия (антацид) вступает в реакцию с водой, и образуется угольная кислота, что приводит к увеличению концентрации вещества в правой части реакции. Чтобы восстановилось равновесие, угольная кислота разлагается на воду и углекислый газ, который мы и наблюдаем в виде пузырьков.


