
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химической реакции. Закон действующих масс. Физический смысл константы скорости. ⇐ ПредыдущаяСтр 5 из 5
Скорость гомогенной (однофазной) реакции зависит от природы реагирующих веществ, их концентрации и температуры. Скорость гетерогенных (многофазных) процессов зависит от размеров и состояния поверхности раздела фаз. Примечание. Гетерогенные – процессы, происходящие на поверхности раздела соприкасающихся фаз. (горение топлива, окисление металлов кислородом воздуха). Закон действующих масс. Справедлив для гомогенных реакций. Формулировка: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Константа скорости обозначается как 28.Молекулярность и порядок реакции.Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):H2S → H2 + SБимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):СН3Вr + КОН → СН3ОН + КВrТримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:О2 + NО + NО → 2NО2Реакции с молекулярностью более трёх неизвестны.Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Реакция нулевого порядка Кинетическое уравнение имеет следующий вид:
29.Кинетическая классификация по степени сложности. Обратимые и необратимые реакции. По степени сложности реакции подразделяются на изолированные, параллельные, сопряженные, последовательные (многоступенчатые), обратимые и необратимые. Изолированные – при их протекании образуются продукты только одного типа. Параллельные – в ходе них взятые вещества одновременно реагируют в двух или более направлениях (образуются разные продукты).Пример. Разложение бертолетовой соли 30.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса.Энергия активации химической реакции.Аналитический и графический метод расчета.Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.Уравнение, которое описывает это правило, следующее:
Аналитический метод определения энергии активации применим, если есть возможность определить две константы скорости при двух температурах.
|
||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 748; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.109.30 (0.007 с.) |
 Пример.
Пример. 
 в квадратных скобках концентрации веществ. A+2B=3D
в квадратных скобках концентрации веществ. A+2B=3D 
 «k» не зависит от концентрации в каждый момент времени.Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
«k» не зависит от концентрации в каждый момент времени.Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л. Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка:  Приведение уравнения к линейному виду даёт уравнение:
Приведение уравнения к линейному виду даёт уравнение:  Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:  Период полупревращения:
Период полупревращения:  Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид:  или
или  В первом случае скорость реакции определяется уравнением
В первом случае скорость реакции определяется уравнением  Линейная форма уравнения:
Линейная форма уравнения:  Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени: 
 Во втором случае выражение для константы скорости реакции будет выглядеть так:
Во втором случае выражение для константы скорости реакции будет выглядеть так:  Период полупревращения (для случая равных начальных концентраций!):
Период полупревращения (для случая равных начальных концентраций!): 
 Скорость реакции:
Скорость реакции:  Сопряженные – совместные реакции типа:
Сопряженные – совместные реакции типа:  Вторая реакция протекает лишь совместно с первой. А – актор реакции, B – индуктор реакции, С – акцептор. Последовательные.
Вторая реакция протекает лишь совместно с первой. А – актор реакции, B – индуктор реакции, С – акцептор. Последовательные.  В – промежуточный продукт. Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции: v=v1-v2Различают практически необратимые и совершенно необратимые реакции. Практически необратимые – реакции, в результате которых образуется осадок. Совершенно необратимые – протекают только в одном направлении. Пример.
В – промежуточный продукт. Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции: v=v1-v2Различают практически необратимые и совершенно необратимые реакции. Практически необратимые – реакции, в результате которых образуется осадок. Совершенно необратимые – протекают только в одном направлении. Пример. 
 Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:  Уравне́ниеАрре́ниуса устанавливает зависимость константы скоростиkхимической реакции от температурыT.Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации
Уравне́ниеАрре́ниуса устанавливает зависимость константы скоростиkхимической реакции от температурыT.Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 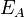 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией  , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:  Здесь Aхарактеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная.В рамках теории активных соударений Aзависит от температуры, но эта зависимость достаточно медленная:
Здесь Aхарактеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная.В рамках теории активных соударений Aзависит от температуры, но эта зависимость достаточно медленная:  Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Типичное обозначение энергии реакции - Ea. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Типичное обозначение энергии реакции - Ea. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:  . С повышением температуры растёт вероятность преодоления энергетического барьера. Уравнение Аррениуса часто представляют в логарифмической форме:lnk = lnА – Еа\RT удобной для графического определения энергии. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
. С повышением температуры растёт вероятность преодоления энергетического барьера. Уравнение Аррениуса часто представляют в логарифмической форме:lnk = lnА – Еа\RT удобной для графического определения энергии. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T). Здесь tga =
Здесь tga =  .
. ;
; 
 ;
; 




