
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вплив тиску на положення рівновагиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Тиск не впливає на значення Якщо СаСО3(кр.) → СаО(кр.) + СО2(г.)
↓Р призведе до зсуву рівноваги праворуч
Якщо Fe(α) + 2О2(г.) → Fe3O4(кр.)
↓Р призведе до зсуву рівноваги ліворуч Якщо 4H2O(г.) + 3 Fe(α) → Fe3O4(кр.) + 4H2(г.) Тиск не впливає на положення рівноваги, Приклад 23. Як потрібно змінити температуру та тиск у рівноважній системі MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α), щоб збільшити вихід продукту? Розв’язок. З попереднього прикладу відомо, що Отже, для збільшення виходу Mn(α) необхідно підвищувати температуру та знижувати тиск. 2.8 Розрахунок теплового ефекту та КР при різних температурах за рівнянням ізобари хімічної реакції З рівняння ізобари в диференційному вигляді
Тоді
– рівняння ізобари хімічної реакції в інтегральному вигляді. В невеликому інтервалі температур можна припустити, що
Визначення 1) якщо 2) у невеликому температурному інтервалі або при наближених розрахунках можна припустити, що величина
Розмірність константи рівноваги збігатиметься з розмірністю відомої константи, яку можна підставляти в рівняння в будь-яких одиницях виміру (атм, Па). Користуючись рівнянням (2.12) за відомим тепловим ефектом процесу та константі рівноваги при одній температурі можна визначити температуру, при якій константа рівноваги буде набувати певного значення.
Приклад 24. Тиск дисоціації Розв’язок. Для визначення теплового ефекту хімічного процесу скористуємось рівнянням (2.11).
Відповідно рівнянню (2.13) температура, при якій тиск дисоціації буде становити 1,013·105 Па буде:
2.9 Розрахунок КР за величиною зміни енергії Гіббса Константа рівноваги реакції пов’язана зі зміною стандартної енергії Гіббса рівнянням. Якщо відоме значення
У разі, коли величина
Розглянемо можливі варіанти розрахунку 1) Якщо реакція відбувається в конденсованій системі, можна прийняти
2) Якщо
3) Якщо Приклад 26. Для хімічного процесу MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити константу рівноваги при температурі 600 К, якщо Розв’язок. З попередніх прикладів виписуємо: Користуючись рівнянням (2.14) знаходимо:
За умов, що
ФАЗОВІ РІВНОВАГИ
|
||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 488; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.226.158 (0.007 с.) |

 і
і  (вихід продукту реакції) при Т=const, оскільки
(вихід продукту реакції) при Т=const, оскільки  , якщо реагенти – ідеальні гази. Проте сама рівновага на зміну тиску реагує зміщенням у певному напрямку.
, якщо реагенти – ідеальні гази. Проте сама рівновага на зміну тиску реагує зміщенням у певному напрямку. > 0:
> 0:
 ↑Р призведе до зсуву рівноваги ліворуч
↑Р призведе до зсуву рівноваги ліворуч


 , тобто
, тобто 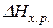 > 0, то для збільшення виходу Mn(α) (тобто зсуву рівноваги праворуч) необхідно температуру підвищити.
> 0, то для збільшення виходу Mn(α) (тобто зсуву рівноваги праворуч) необхідно температуру підвищити.  ;
;  випливає, що
випливає, що  , звідки
, звідки  .
. , або
, або
 , тоді
, тоді
 за рівнянням (2.10) можна проводити з різним ступенем точності:
за рівнянням (2.10) можна проводити з різним ступенем точності: = 0, то другим доданком у рівнянні можна знехтувати і вважати, що константа рівноваги не залежить від температури, тобто
= 0, то другим доданком у рівнянні можна знехтувати і вважати, що константа рівноваги не залежить від температури, тобто 
 чи
чи 
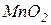 при 836 К становить 75850 Па, а при 791 К – 25860 Па. Визначити температуру, при якій тиск дисоціації буде становити 1,013·105 Па.
при 836 К становить 75850 Па, а при 791 К – 25860 Па. Визначити температуру, при якій тиск дисоціації буде становити 1,013·105 Па. .
. .
. при заданій температурі, то
при заданій температурі, то  .
.
 за допомогою цього рівняння:
за допомогою цього рівняння: ≈ 0.
≈ 0.
 , то:
, то:
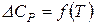 , то треба враховувати залежність теплоємності від температури
, то треба враховувати залежність теплоємності від температури ;
;  ;
;  .
.

 .
. .
.


