
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення середньої теплоємності в заданому інтервалі температур
Середню ізобарну теплоємність можна визначити, якщо спочатку обчислити кількість теплоти, необхідної для нагрівання речовини від Т1 до Т2,:
Величина QP залежить від того, як поводить себе теплоємність речовини при нагріванні: 1) якщо
2) якщо
Якщо рівняння (1.12) поділити на ΔТ = Т2- Т1, отримаємо вираз для визначення
Приклад 8. Залежність теплоємності MnO(кр.) від температури має вигляд: Ср = 46,48 +8,12 · 10-3 ·Т –3,68·105 Т-2 Визначити кількість теплоти, необхідної для розплавлення 5 кг MnO(кр.), що знаходиться при температурі Т = 298 К. Розв’язок. Кількість теплоти, що необхідна для плавлення 5 кг MnO(кр.) становить:
де
де Знаходимо середню мольну теплоємність MnO(кр.), користуючись рівняннями (1.15).
Користуючись рівнянням (1.8), знаходимо питому середню теплоємність MnO(кр.)
Отже Знаходимо питому теплоту плавлення
Отже Кількість теплоти, що необхідна для плавлення 5 кг MnO(кр.) становить:
Розрахунок теплоємності в результаті перебігу хімічного процесу за стандартних умов Якщо в хімічній системі перебігає хімічний процес (1.1), то зміна теплоємності в результаті реакції визначається рівнянням:
де Таким чином, зміна теплоємності в результаті протікання хімічної реакції дорівнює сумі теплоємностей продуктів реакції мінус сума теплоємності вихідних речовин з урахуванням стехіометричних коефіцієнтів.
Приклад 9. Розрахувати за с.у. зміну теплоємності в результаті перебігу хімічного процесу MnO2(кр.) + C(графит) → 2CO(г.) + Mn(α). Розв’язок. Згідно з рівнянням (1.17) запишемо:
Таблиця 1.2 – Стандартні теплоємності вихідних речовин та продуктів реакції.
Отже,
Розрахунок теплового ефекту хімічної процесу при будь-якій Температурі Залежність теплового ефекту хімічного процесу від температури ілюструє закон Кірхгофа.
де Температурний коефіцієнт теплового ефекту процесу дорівнює зміні теплоємності системи в наслідок цього процесу. Аналіз рівняння Кірхгофа Якщо тепловий ефект ендотермічного процесу ( тепловий ефект екзотермічного процесу ( Зменшення температури чинить протилежну дію. Якщо тепловий ефект ендотермічного процесу ( тепловий ефект екзотермічного процесу ( Зменшення температури чинить протилежну дію. Якщо тепловий ефект реакції не залежить від температури. Якщо відомий тепловий ефект реакції за с.у. ΔН0298, то за законом Кірхгофа можна розрахувати його для іншої температури:
При наближених розрахунках: 1) за умови, що
2) В невеликому інтервалі температур можна припустити, що
3) При точних розрахунках потрібно враховувати температурну залежність
Приклад 10. Розрахувати тепловий ефект хімічного процесу MnO2(кр.) + C(графит) → 2CO(г.) + Mn(α) за умов, що ΔСр = const при температурі 500 К. Розв’язок. З попередніх прикладів виписуємо, що
Звідси випливає, що тепловий ефект даного хімічного процесу збільшується з підвищенням температури.
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 591; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.12.172 (0.008 с.) |


 , тоді:
, тоді: ;
;
 , тоді для неорганічних речовин:
, тоді для неорганічних речовин: .
.
 . Для неорганічних речовин воно набуває вигляду:
. Для неорганічних речовин воно набуває вигляду: .
.
 . Температура плавлення MnO(кр.) становить 2058 К, а теплота плавлення – 54,40
. Температура плавлення MnO(кр.) становить 2058 К, а теплота плавлення – 54,40  .
. ,
, – кількість теплоти, що необхідна для нагрівання MnO(кр.) від 298 К до Тпл .;
– кількість теплоти, що необхідна для нагрівання MnO(кр.) від 298 К до Тпл .;  – кількість теплоти, що необхідна для плавлення MnO(кр.).
– кількість теплоти, що необхідна для плавлення MnO(кр.). ,
,  ,
, – питома теплота плавлення,
– питома теплота плавлення,  ,
,  .
. .
. .
. .
.
 .
. .
.
 чи
чи

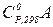 та
та  – стандартні ізобарні теплоємності вихідних речовин; а
– стандартні ізобарні теплоємності вихідних речовин; а  та
та  – стандартні ізобарні теплоємності продуктів реакції.
– стандартні ізобарні теплоємності продуктів реакції.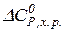 > 0;
> 0; 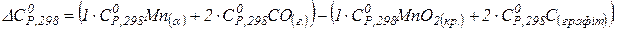 Для цього виписуємо дані з довідника, таблиця 1.2.
Для цього виписуємо дані з довідника, таблиця 1.2.
 .
. ,
,
 – температурний коефіцієнт теплового ефекту.
– температурний коефіцієнт теплового ефекту. > 0, то зі зростанням температури:
> 0, то зі зростанням температури: > 0) – збільшується;
> 0) – збільшується; .
.
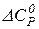 = 0, тоді
= 0, тоді  або
або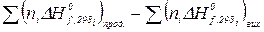 ;
;
 ;
;
 .
.
 , а
, а  . Користуючись рівнянням (1.21), запишемо:
. Користуючись рівнянням (1.21), запишемо:



