
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розрахунок теплового ефекту хімічної реакції за стандартних умовСодержание книги
Поиск на нашем сайте
Якщо в хімічній системі перебігає хімічний процес:
то тепловий ефект буде визначатися рівнянням:
де Таким чином, тепловий ефект хімічної реакції дорівнює алгебраїчній сумі теплот утворення продуктів реакції мінус алгебраїчна сума теплот утворення вихідних речовин. Теплоти утворення хімічних сполук наведені у довідниках за стандартних умов. Приклад 1. Для хімічної реакції MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити тепловий ефект за с.у. Розв’язок. Згідно з рівнянням (1.2) запишемо:
Для цього виписуємо дані з довідника, таблиця 1.1. Таблиця 1.1 – Теплоти утворення вихідних речовин та продуктів реакції за стандартних умов.
1.1.2 Зв’язок між тепловими ефектами при постійному тиску і об’ємі Qp і Qv (ΔН і ΔU)
де Аналіз цих рівнянь свідчить, що: якщо Δn = 0, то ΔH = ΔU (Qp = Qv); якщо Δn > 0, то ΔH > ΔU (Qp > Qv); якщо Δn < 0, то ΔH < ΔU (Qp < Qv). В хімії найчастіше застосовують ізобарні процеси. Тому далі ми будемо розглядати ізобарні теплові ефекти, враховуючи те, що все це стосується і ізохорних теплових ефектів. Приклад 2. Для хімічної реакції MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити зміну внутрішньої енергії при Т = 298К. Розв’язок. Згідно з рівнянням (1.3) запишемо, що З попередньої задачі виписуємо, що Приклад 3. Для хімічної реакції MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити різницю між ізобарним та ізохорним тепловими ефектами при Т = 298К. Розв’язок. Користуючись рівнянням (1.3) запишемо, що Приклад 4. Для хімічної реакції MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити кількість теплоти, яка виділяється при взаємодії 3 кг графіту з MnO2(кр.) за Т = 298 К. Кількість теплоти, яка виділяється при взаємодії 3 кг графіту з MnO2(кр.) обчислюється як:
де
Отже, Теплоємність Теплоємність – це кількість теплоти, що необхідна для нагрівання системи на один градус. Істинна теплоємність – відношення безмежно малої кількості теплоти, яка підведена до системи, до відповідно безмежно малої зміни температури.
Середня теплоємність – відношення кількості підведеної теплоти в систему до викликаної цим зміни температури.
Оскільки dQp = ΔH dQv = ΔU, то істинна та середня теплоємності при Р= const: V= const: Взаємозв’язок середньої та істинної теплоємностей описується:
Теплоємність речовини – це кількість теплоти, яка необхідна для нагрівання певної кількості речовини на 1К. Молярна теплоємність Взаємозв’язок молярної та питомої теплоємностей визначається рівнянням:
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 485; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.156.91 (0.01 с.) |

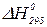 = (
= ( +
+ 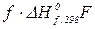 ) – (
) – (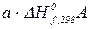 +
+ 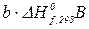 ) чи
) чи 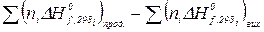 ,
,
 і
і 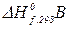 – теплоти утворення вихідних речовин, а
– теплоти утворення вихідних речовин, а  ,
, 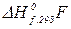 – теплоти утворення продуктів реакції;
– теплоти утворення продуктів реакції;  – стехіометричні коефіцієнти в рівнянні хімічної реакції.
– стехіометричні коефіцієнти в рівнянні хімічної реакції.
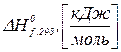

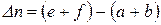 – зміна кількості молів газоподібних речовин в результаті перебігу хімічного процесу;
– зміна кількості молів газоподібних речовин в результаті перебігу хімічного процесу; 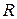 – універсальна газова стала,
– універсальна газова стала, 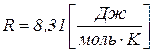 ;
; 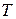 – температура, К.
– температура, К.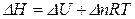 , звідси
, звідси 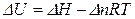 .
. ,
,  ; Отже,
; Отже,  .
.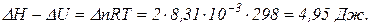
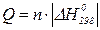 ,
,
 – кількість молів речовини
– кількість молів речовини  , де
, де  – маса речовини, г;
– маса речовини, г; 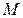 – молярна маса речовини,
– молярна маса речовини, 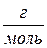 .
.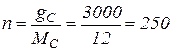 , звідси
, звідси 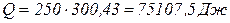 .
.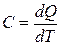
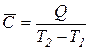
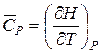
 ;
;
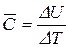 .
.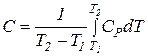
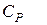 має розмірність
має розмірність 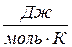 , а питома
, а питома 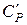 –
– 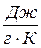 ,
, 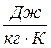 .
.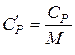 .
.



