
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Зміна ізобарно-ізотермічного потенціалу в хімічному процесіСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Якщо в системі протікає процес (1.1), то зміна ізобарно-ізотермічного потенціалу буде визначатися як:
де Таким чином, зміна енергії Гіббса в результаті перебігу хімічної реакції дорівнює алгебраїчній сумі ізобарно-ізотермічних потенціалів утворення продуктів реакції мінус алгебраїчна сума ізобарно-ізотермічних потенціалів вихідних речовин. Приклад 16. Для хімічної реакції MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити зміну енергії Гіббса за с.у.(напрямок перебігу процесу за с.у.) Розв’язок. Згідно з формулою (1.40) запишемо:
Для цього виписуємо дані з довідника (див. таблиця 1.4).
Таблиця 1.4 – Стандартна енергія Гіббса продуктів реакції та вихідних речовин.
Оскільки Якщо при розрахунках: ΔG0х.р.<0 – це означає, що коли всі речовини, які беруть участь у хімічному процесі, знаходяться у стандартних умовах, реакція перебігає у прямому напрямку; ΔG0х.р.>0 – це означає, що прямий процес за даних умов неможливий, а вірогідне протікання зворотнього процесу. ΔG0х.р.=0 – це означає, що система знаходиться у стані рівноваги. 1.4.2 Розрахунок Виходячи з рівняння Гіббса - Гельмгольца
1)
2.
3.
Приклад 17. Для хімічного процесу MnO2(кр.) + 2C(графіт) → 2CO(г.) + Mn(α) визначити зміну енергії Гіббса за умов, що Розв’язок.
ХІМІЧНІ РІВНОВАГИ Закон діючих мас. Константи рівноваги гомогенних реакцій Якщо в системі перебігає хімічний процес (1.1), то при
де
Ці рівняння є математичним виразом закону діючих мас: відношення добутку рівноважних концентрацій (парціальних тисків) продуктів реакції, узятих у степенях, що дорівнюють їх стехіометричним коефіцієнтам, до аналогічного добутку для вихідних речовин при даній температурі є величина стала.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 876; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.57.73 (0.007 с.) |

 = (
= ( +
+  ) – (
) – ( +
+  ) чи
) чи
 ,
,
 і
і  – стандартні енергії Гіббса (ізобарно-ізотермічні потенціали) утворення вихідних речовин;
– стандартні енергії Гіббса (ізобарно-ізотермічні потенціали) утворення вихідних речовин; 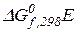 ,
,  – стандартні енергії Гіббса (ізобарно-ізотермічні потенціали) утворення продуктів реакції;
– стандартні енергії Гіббса (ізобарно-ізотермічні потенціали) утворення продуктів реакції;  – стехіометричні коефіцієнти в рівнянні хімічної реакції.
– стехіометричні коефіцієнти в рівнянні хімічної реакції.


 > 0, то реакція перебігає в зворотному напрямку.
> 0, то реакція перебігає в зворотному напрямку. хімічного процесу при будь-якій заданій температурі
хімічного процесу при будь-якій заданій температурі , в свою чергу
, в свою чергу ,
,  , відповідно
, відповідно .
.
 :
: (у конденсованих системах);
(у конденсованих системах);
 , то
, то  (
(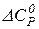 – не залежить від температури)
– не залежить від температури)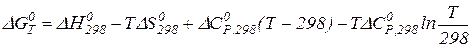 ;
;
 , тоді
, тоді
 ,
,  та Т = 500 К.
та Т = 500 К. ;
;  ;
;  .
.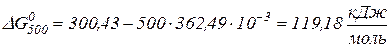 .
.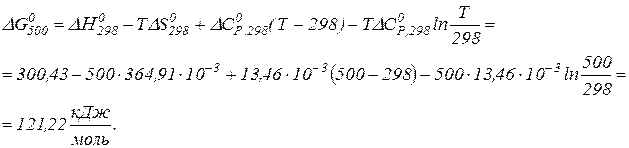
 ,
, ,
, 
 – рівноважні концентрації учасників реакції;
– рівноважні концентрації учасників реакції; 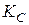 – константа рівноваги, виражена через рівноважні концентрації учасників реакції;
– константа рівноваги, виражена через рівноважні концентрації учасників реакції;  – рівноважні тиски учасників процесу;
– рівноважні тиски учасників процесу;  – константа рівноваги, виражена через рівноважні парціальні тиски учасників реакції.
– константа рівноваги, виражена через рівноважні парціальні тиски учасників реакції.


