
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електродні потенціали. Гальванічні елементи.Содержание книги Поиск на нашем сайте
Устрій в якому енергія окисно-відновних реакцій перетворюється на електричну називається гальванічним елементом. При цьому окисно-відновну реакцію необхідно здійснити так, щоб процеси окиснення і відновлення було розділено у просторі і створити можливість перебігу електронів від відновника (анод) до окисника (катод) по зовнішньому провіднику. Суттєвим для перетворення хімічної енергії на електричну є наявність двох різнорідних провідників з електронною провідністю, занурених у розчин з йонною провідністю (розчини електролітів); ці останні сполучаються між собою напівпроникною перетинкою, соляним або електрохімічним місточком, який необхідний для замикання ланцюжка між двома електродами та забезпечення електронейтральності розчинів. На аноді протікає процес окиснення На межі: метал - розчин (вода, розчин електроліту) виникає подвійний електричний шар і з’являється різниця електричних потенціалів, який заміряти неможливо. Однак можна заміряти різницю потенціалів двох хімічно різних електродів, прийнявши один з них за електрод порівняння, це – електродний потенціал порівняння Різниця потенціалів стандартного водневого електрода та будь-якого електрода за стандартних умов називається стандартним електродним потенціалом
Різниця потенціалів, яка виникає між металом і розчином його солі (
Електроліз
Процес протікання окислювально-відновних реакцій під дією постійного електричного струму в розчинах або розплавах електролітів називається електролізом. На катоді протікають процеси відновлення:
На аноді протікають процеси окиснення:
Для розповсюджених катіонів існує такий ряд розрядження на катоді:
легко розряджаються важко розряджаються Кількісною характеристикою електролізу є закони Фарадея (1833р): І · τ = m/Мекв·F, де І – сила струму, А; τ – час, с; m – маса речовини, г; Мекв – молярна маса еквівалента, г/моль; F – стала фарадея. νА/νВ=ZА/ZВ, де νА,νВ – кількість речовин А і В ZА/ZВ – еквівалентні числа речовин А і В Практично маси (об’єми) речовин, виділених на електродах менші від розрахованих за законами Фарадея, внаслідок перенапруги, яка виникає з різних причин. Розраховують величину η – вихід за струмом
Найбільший вихід за струмом мають легко розряджу- вальні метали Cu, Ag, Au та ін.
Завдання для самостійного розв’язання 6.2.1. Відповісти на запитання. 1. Пояснити вираз: «окисно- відновні реакції можуть бути як джерелами, так і споживачами електричного струму». 2. Чому практичні значення ЕРС гальванічного елемента, маси (об’єми) речовин, що виділяються на електродах при електролізі, відрізняються від теоретично розрахованих? 3. Охарактеризувати практичне використання процесів, які протікають в гальванічних елементах,при електролізі.
6.2.2. Розв’язати задачі. 1. У дві склянки з блакитним розчином мідного купоросу помістили: до першої пробірки - цинкову пластинку, до другої - срібну. У якій склянці і чому колір розчину поступово зникає? Скласти молекулярні та електронні рівняння відповідних реакцій, струмоутворюючу реакцію, схему гальванічного елементу, розрахувати ЕРС з використанням стандартних значень електродних потенціалів. (1,1В) 2. Скласти схему гальванічного елемента, робота якого ґрунтується на реакції. Ni + Pb(NO3)2 = Ni(NO3)2 + Pb Написати електронні рівняння анодного та катодного процесів. Обчислити ЕРС цього елемента, якщо [ Ni2+ ]=0,01мол/л, [ Pb2+ ]=0,0001мол/л. (0,061В)
3. Розрахувати масу речовини, яка виділиться на катоді, масу та об’єм виділеної речовини на аноді, якщо через розчин аргентум нітрату пропускали струм силою 2А на протязі 5 годин. Скласти електронні рівняння процесів на катоді та аноді. (40,3г; 2,99г; 2,09л)
6.2.3 Виконати завдання 6.2.3.1 Гальванічний елемент Для даного гальванічного елемента виконати: 1. Визначити який з двох електродів може бути анодом, який катодом (стандартні умови)? Чому? 2. Записати процеси, які протікають на аноді та катоді у працюючому гальванічному елементі; 3. Записати струмоутворюючу реакцію; 4. Скласти схему гальванічного елемента; 5. Визначити е.р.с. гальванічного елемента за стандартних умов та при концентрації йонів на аноді 0,01 моль/л. 6.2.3.2 Електроліз водних розчинів 1. Скласти схеми процесів, які протікають при електролізі водного розчину даної речовини з даними електродами. 2. Розрахувати маси речовин, які утворюються, якщо електроліз буде проходити при силі струму І (А) протягом певного часу Δt (год).
Прилади та реактиви 1. Прилади: гальванічний елемент, електролізери з графітовим та мідним електродами. 2. Речовини: метали магній, залізо, цинк, мідь. 3. Розчини: хлоридна кислота(2N), купрум(ІІ) сульфат, цинк сульфат, плюмбум(ІІ) нітрат, нікол(ІІ) сульфат, калій йодид, розчин крохмалю.
Вказівки з техніки безпеки 1. Дотримуватися правил роботи з розчинами кислот та солей 2. При роботі з електролізером дотримуватися наступних правил: – вмикати і вимикати випрямляч струму лише після перевірки викладачем правильності приєднання електродів до клем випрямляча; – виймати та занурювати електроди до електролізу дозволяється лише при вимкнутому випрямлячі струму.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 415; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.74.47 (0.008 с.) |

 , на катоді – відновлення
, на катоді – відновлення  .
. . Звичайно, за електрод порівняння беруть водневий, нульовий електрод, занурений в
. Звичайно, за електрод порівняння беруть водневий, нульовий електрод, занурений в  розчин
розчин  при
при  ,
,  (стандартні умови), його електродний потенціал
(стандартні умови), його електродний потенціал  .
.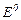 (табличні дані). Значення
(табличні дані). Значення 
 - універсальна газова стала
- універсальна газова стала  ;
; - термодинамічна температура,
- термодинамічна температура,  ;
;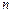 - заряд йону (кількість електронів);
- заряд йону (кількість електронів); - стала Фарадея
- стала Фарадея 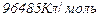 ;
; - активність йонів в розчині.
- активність йонів в розчині. ) може служити мірою його активності. Чим більше від’ємне значення
) може служити мірою його активності. Чим більше від’ємне значення 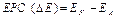







 Для розповсюджених аніонів – ряд розрядження на аноді:
Для розповсюджених аніонів – ряд розрядження на аноді:




