
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания железа (III) в раствореСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: определить массу соли Fe2(SO4)3 × 6H2O или железа(III) в пробе (г). Сущность работы. Под действием NH4OH железо(III) осаждается в виде гидроксида:
Растворимость гидроксида железа Fe(ОН)3 очень мала Полученный осадок прокаливают при температуре 900°С. При этом Fe(ОН)3 (или Fe2О3 × n Н2О) теряет воду и превращается в оксид, который потом взвешивают:
Длительного прокаливания следует избегать, чтобы не произошло частичное восстановление Fe2О3 до Fe3О4, так как это приведет к погрешностям определения. Оборудование и реактивы: аналитические весы, электрическая плитка, электропечь, химический стакан (150–200 мл), стеклянная палочка с резиновым наконечником, конические колбы, пробирка, штатив с кольцом, воронка, мерный цилиндр, беззольный фильтр, 10%-ный раствор NH4OH, 2%-ный раствор NH4NO3, 2 н. раствор HNO3, 2 н. раствор BaCl2. Выполнение работы 1. Анализируемый раствор получают в стакан у лаборантов. Номер стакана записывают в лабораторный журнал. В стакан помещают стеклянную палочку с резиновым наконечником (направлен вниз). 2. По палочке в стакан добавляют 2–3 мл 2 н. HNO3 (объем отмеряют цилиндром). 3. Раствор нагревают на плитке, не допуская кипения. 4. К горячему раствору по палочке добавляют 10%-ный раствор NH4OH, перемешивая раствор после добавления каждой порции до появления бурого осадка и явного запаха аммиака. 5. К раствору с осадком добавляют 50–70 мл горячей дистиллированной воды, дают осадку собраться на дне стакана. Проверяют полноту осаждения железа(III), добавляя несколько капель NH4OH. 6. Через 5 мин приступают к фильтрованию раствора через беззольный фильтр методом декантации. 7. Осадок в стакане многократно промывают горячим 2%-ным раствором NH4NO3. Раствор декантируют на фильтр. Осадок продолжают промывать горячим NH4NO3 до полного удаления из него 8. Осадок из стакана количественно переносят на фильтр. Оставшиеся на стенке стакана и палочке частицы осадка снимают четвертинкой беззольного фильтра, которую присоединяют к основному осадку. 9. Фильтр с осадком достают из воронки, загибают края фильтра (рис. 6) и помещают в фарфоровый тигель, предварительно записав его номер. 10. Фильтр обугливают при 400°С, затем тигель с осадком прокаливают 30 мин в электропечи при температуре 900°С. 11. Тигельизвлекают из электропечи и помещают в эксикатор. Как только тигель охладится до комнатной температуры, проводят первое взвешивание. 12. Тигель снова помещают в электропечь, прокаливают 30 мин, охлаждают и взвешивают. 13. Если разница результатов последнего и предпоследнего взвешивания больше 0,0002 г, то повторяют п. 12 до достижения постоянной массы, если меньше, то переходят к п. 14. 14. По достижении постоянной массы осадок из тигля высыпают, протирают его стенки фильтровальной бумагой и взвешивают пустой тигель на тех же аналитических весах. По разности двух последних взвешиваний определяют массу гравиметрической формы Fe2O3. 15. Рассчитывают массу Fe3+ или соли Fe2(SO4)3 · 6H2O в пробе, г.
Лабораторная работа № 6
|
|||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 432; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.17.3 (0.006 с.) |

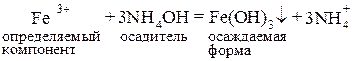

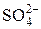 . Полноту удаления проверяют по качественной реакции на
. Полноту удаления проверяют по качественной реакции на 


