
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Организация лабораторных занятийСодержание книги
Поиск на нашем сайте
Аналитическая химия
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Минск БГТУ 2012
Учреждение образования «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Аналитическая химия
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Рекомендовано учебно-методическим объединением высших учебных заведений
ББК 24.4я73 А64 Авторы: А. Е. Соколовский, Н. Ф. Шакуро, А. К. Болвако, Е. В. Радион
Рецензенты: кафедра аналитической химии доктор химических наук,
Все права на данное издание защищены. Воспроизведение всей книги или ее части не может быть осуществлено без разрешения учреждения образования «Белорусский государственный технологический университет».
ISBN 978-985-530-144-9. Учебно-методическое пособие содержит 20 лабораторных работ по качественному и количественному химическому анализу. Работы по гравиметрии и различным методам титриметрии являются многоуровневыми – от типовых до более сложных, предполагающих анализ многокомпонентных смесей, реальных природных и технологических объектов. Особенностями практикума является разнообразная тематика экспериментальных заданий и компьютерная обработка результатов анализа. Приведены основные сведения об используемой химической посуде и химико-аналитическом оборудовании, приемах работы с ними, а также о технике выполнения химико-аналитических операций. Пособие предназначено для студентов химико-технологических специальностей. УДК 543(076.5)(075.8) ББК 24.4я73
ПРЕДИСЛОВИЕ Организация лабораторных занятий Лабораторные занятия по аналитической химии проводятся согласно графику прохождения лабораторного практикума (табл. 1). Таблица 1 Ведение рабочего журнала Отчеты о выполненных лабораторных работах оформляются в отдельной тетради, которая является рабочим журналом студента. По желанию студента можно вести электронный рабочий журнал с распечаткой отчетов для проверки преподавателем. После защиты работ отчеты подписываются преподавателем и служат документом, подтверждающим успешное выполнение лабораторного практикума. При выполнении лабораторных работ по теме «Качественный анализ» отчет представляется по форме 1 (см. приложение). При выполнении лабораторных работ по теме «Количественный анализ» отчет представляется по разным формам (см. приложение) в зависимости от изучаемого метода анализа и цели работы. При выполнении работы по гравиметрии отчет представляется по форме 2, при выполнении работ по титриметрии – по форме 3 (стандартизация рабочего раствора) или форме 4 (выполнение контрольного анализа). При выполнении работ по количественному анализу обязательным является соблюдение правил записи результатов измерения и указание единиц измерения. Точность измерения основных величин и правила записи результатов измерения приведены в табл. 2, а точность расчета величин – в табл. 3. При выполнении всех лабораторных работ по количественному анализу можно использовать документ Microsoft Excel «Практикум по АХ и ФХМА» с целью: – оценки неопределенности измерений; – проведения Q -теста для исключения грубых промахов, если имеется достаточная выборка – 4 и более результатов параллельных измерений; – проведения статистической обработки результатов анализа: расчет среднего, дисперсии, среднеквадратичного отклонения, доверительного интервала и др. Таблица 2 Точность измерения основных величин и правила записи результатов
Таблица 3 Точность расчета величин
Отчеты о проведенной компьютерной обработке данных распечатываются и прикладываются к отчету о выполненной лабораторной работе. Учебно-методическое обеспечение дисциплины Для изучения курса аналитической химии имеется учебная литература, кафедральные издания на электронных и бумажных носителях, программное обеспечение и т. п. Список рекомендуемой литературы и учебно-методических материалов приведен в приложении. Литературу можно получить в библиотеке БГТУ, в т. ч. материалы на электронных носителях. Кроме того, кафедральные разработки и прикладное программное обеспечение можно записать на флэш-карту в учебных лабораториях, многие из них размещены на сайте кафедры. Для самостоятельной работы рекомендуется использовать следующие учебно-методические материалы: 1) для изучения теории: – учебники [1, 4–6]; – конспекты лекций и их электронные версии; – электронные кафедральные издания [12, 18]; – кафедральное учебно-методическое пособие [11] и его электронная версия; – электронная версия кафедрального учебно-методического пособия [13]; 2) для выполнения лабораторных работ и составления отчетов о выполненных лабораторных работах: – настоящее издание лабораторного практикума и его электронная версия; – кафедральная разработка «Электронный рабочий журнал по аналитической химии»; – лабораторные практикумы [2, 4, 7, 14]; 3) для решения расчетных задач: – задачники [3, 8]; – учебно-методическое пособие [14]; – электронная версия кафедрального учебно-методического пособия [14]; – электронное кафедральное издание [19]; 4) для поиска справочной информации: – справочник [10]; – кафедральное справочное издание [16] и его электронная версия; 5) для выполнения проблемного задания: – кафедральное издание [17] и его электронная версия; – лабораторные практикумы [2, 4, 7]; 6) компьютерные программы, презентации и видеоматериалы:
В настоящем издании использованы следующие обозначения:
КАЧЕСТВЕННЫЙ АНАЛИЗ При проведении качественного анализа неорганического вещества его переводят в раствор и затем обнаруживают входящие в его состав катионы и анионы. Для удобства выполнения анализа катионы и анионы подразделяются на аналитические группы, в которые включены сходные по химико-аналитическим свойствам ионы. Классификации катионов и анионов, которые используются при выполнении лабораторного практикума, приведены в табл. 4–5. Классификации имеют большое значение при систематическом ходе анализа сложной смеси. В этом случае ионы выделяют из нее не поодиночке, а целыми группами, используя групповые реагенты. Систематический ход анализа подразумевает последовательное выполнение следующих действий: – разделение ионов на группы с помощью групповых реагентов; – разделение мешающих ионов внутри каждой группы; – обнаружение ионов с помощью характерных реакций. При дробном методе анализа ионы открывают непосредственно из анализируемой смеси, используя селективные и специфические реакции.
Таблица 4 Таблица 5 Лабораторная работа № 1 Предварительные испытания
Проба на присутствие K+. Если ионNH4+ не обнаружен, то можно провести пробу на ион K+ в предварительных испытаниях. На предметное стекло помещают каплю исследуемого раствора и нагревают его на плитке до появления каемочки сухой соли. На некотором расстоянии от нее наносят каплю Na2PbCu(NO2)6. Реактив осторожно подводят к сухой каемочке соли и через 2–3 мин рассматривают выпавшие кристаллы под микроскопом. Если в растворе присутствуют ионы K+, то образуются кубические кристаллы K2PbCu(NO2)6 черного или коричневого цвета (рис. 2). Ионы NH4+ образуют такие же кристаллы и поэтому мешают реакции. Систематический ход анализа 2.1. Разделение катионов на группы. К 10–12 каплям исследуемого раствора приливают 1–2 капли NH4ОН и по каплям – NH4Сl (для растворения осадка Мg(ОН)2, который может образоваться при действии NH4ОН). Даже если осадок не образовался, все равно надо добавить 1–2 капли NH4Сl для создания буферного раствора. Затем приливают к раствору избыток (NH4)2СО3 и нагревают содержимое пробирки на водяной бане до 60–70ºС. Если осадок карбонатов катионов II группы образовался, то его отделяют центрифугированием. Чтобы убедиться в полноте осаждения катионов II группы, к прозрачному раствору над осадком добавляют несколько капель (NH4)2СО3. Если раствор мутнеет, прибавляют еще (NH4)2СО3, нагревают, центрифугируют и снова проверяют полноту осаждения. После проведения групповой реакции катионы I и II групп оказываются разделенными: фильтрат содержит катионы I группы, а осадок – катионы II группы в виде карбонатов. 2.2. Анализ фильтрата. Удаление NH4+. Фильтрат переносят в фарфоровый тигель, ставят его на плитку и выпаривают досуха. Затем оставляют тигель на плитке на 20–30 мин для прокаливания сухих солей. Когда прекратится выделение белого дыма, тигель снимают с плитки тигельными щипцами и дают ему остыть. Добавляют в тигель несколько капель дистиллированной воды для растворения сухого остатка. В полученном растворе проверяют полноту удаления ионов NH4+ с помощью реактива Несслера. Для этого каплю раствора переносят на часовое стекло и добавляют 1–2 капли реактива Несслера. Если выпадает красно-бурый осадок, то раствор содержит заметные количества ионов Обнаружение K+ выполняют, как описано выше, если в предварительных испытаниях его не проводили. Обнаружение Мg2+. Ионы Мg2+ открывают, используя одну из реакций: – к 2–3 каплям раствора прибавляют несколько капель NH4Cl, NH4OH и Na2HPO4. В присутствии Mg2+ выпадает белый осадок магнийаммонийфосфата NH4MgPO4; – к 2–3 каплям раствора добавляют несколько капель 2 н. раствора KОН. Содержимое пробирки нагревают на водяной бане. Образование белого аморфного осадка указывает на присутствие ионов Мg2+. Обнаружение ионов Na+ можно проводить только в отсутствие ионов Мg2+ и NH4+, используя микрокристаллоскопическую или пробирочную реакцию с KH2SbO4. Проведение реакций в отсутствие ионов Мg2+
2. Пробирочная реакция с KH2SbO4. В пробирку наливают 2–3 капли раствора, полученного после удаления ионов NH4+. Затем создают строго нейтральную среду, добавляя пипеткой раствор HNO3 или KOH до рН 7 по индикаторной бумаге. К нейтральному раствору прибавляют равный объем раствора реактива KH2SbO4 и перемешивают стеклянной палочкой. Образование белого кристаллического (не аморфного!) осадка свидетельствует о наличии в растворе ионов Na+. Для ускорения образования осадка надо потереть палочкой о стенки пробирки и охладить ее содержимое. Проведение реакции с предварительным отделением ионов Мg2+ Если ионы Мg2+ были обнаружены в предыдущем испытании, то их необходимо предварительно отделить. Для этого к отдельной порции раствора из тигля добавляют несколько капель 2 н. раствора KОН, нагревают на водяной бане и центрифугируют. Проверяют полноту осаждения Мg2+, снова центрифугируют и отбрасывают осадок Мg(ОН)2. Полученный фильтрат нейтрализуют 2 н. раствором НСl до рН 7 по индикаторной бумаге (избыток кислоты недопустим из-за разложения KH2SbO4 в кислой среде!) и выпаривают досуха в фарфоровом тигле. Сухой остаток растворяют в 2–3 каплях дистиллированной воды. В полученном растворе обнаруживают ионы Na+ микрокристаллоскопической реакцией с KH2SbO4 (рис. 3). 2.3. Анализ осадка Растворение осадка. Осадок карбонатов растворяют в 8–10 каплях 2 н. уксусной кислоты, добавляя ее небольшими порциями и перемешивая содержимое пробирки стеклянной палочкой. Обнаружение Ва2+. Отдельную порцию полученного уксуснокислого раствора нагревают на водяной бане и добавляют несколько капель CH3COONa. Затем добавляют избыток K2Cr2O7 так, чтобы раствор стал оранжевым. Если при этом выпадает желтый мелкокристаллический осадок, то в анализируемом растворе присутствуют ионы Ва2+. После охлаждения в раствор над осадком добавляют еще несколько капель K2Cr2O7, проверяя таким образом полноту осаждения ионов Ва2+. После полного осаждения ионов Ва2+ осадок ВаCrО4 отделяют центрифугированием, а фильтрат используют для обнаружения ионов Са2+. Обнаружение Са2+. Катионы открывают в отдельной пробе раствора, не содержащего ионов Ba2+. Для этого к 1–2 каплям раствора прибавляют 2–3 капли раствора (NH4)2C2O4 и нагревают раствор на водяной бане. В присутствии катионов кальция образуется белый кристаллический осадок оксалата кальция. При отсутствии ионов Ва2+ в анализируемом растворе пробу на наличие ионов Са2+ лучше провести в свежей порции уксуснокислого раствора, полученного при растворении осадка карбонатов.
Лабораторная работа № 2 Предварительные испытания Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной палочкой и сравнив полученную окраску с цветной шкалой. Проба на присутствие Fe2+. Ион Fe2+ открывают первым, так как он легко окисляется кислородом воздуха до Fe3+. Небольшую порцию раствора подкисляют 2 н. НСl и приливают к ней 1–2 капли раствора K3[Fe(CN)6], стараясь не перемешивать содержимое пробирки. Выпадение синего осадка Fe3[Fe(CN)6]2 свидетельствует о наличии иона Fe2+. Следует иметь в виду, что в присутствии катионов III группы осадок будет менее интенсивно окрашен. Если основной эффект не проявился, то необходимо зафиксировать побочные эффекты, которые могут наблюдаться за счет возможного присутствия ионов Fe3+, Mn2+ и Zn2+. Проба на присутствие Fe3+. К отдельной порции исследуемого раствора, подкисленной 2 н. HCl, прибавляют несколько капель раствора K4[Fe(CN)6]. Выпадение синего осадка Fe4[Fe(CN)6]3 свидетельствует о наличии иона Fe3+. Присутствие катионов III группы несколько изменяет темно-синий цвет осадка. Следует иметь в виду, что растворы солей Fe2+ всегда содержат примесь Fe3+ за счет окисления кислородом воздуха, поэтому в отчете необходимо указать не только окраску раствора, но и ее интенсивность. Проба на присутствие Zn2+. В центр полоски фильтровальной бумаги наносят каплю раствора дитизона и каплю анализируемого раствора. Появление малиново-красного окрашивания свидетельствует о присутствии ионов Zn2+. Для сравнения полезно провести холостой опыт и модельный опыт:
Систематический ход анализа 2.1. Разделение катионов внутри группы. К 10–12 каплям анализируемого раствора прибавляют при тщательном перемешивании концентрированный раствор NaOH до щелочной реакции по индикаторной бумаге. Затем прибавляют еще 5–8 капель раствора NaOH и В результате катионы III группы оказываются разделенными: фильтрат содержит анионы 2.2 Анализ фильтрата Обнаружение Cr3+. Для установления наличия ионов Cr3+ их окисляют до При проведении реакции в отсутствии амилового спирта синяя окраска также образуется, однако она менее интенсивна и быстро исчезает. Обнаружение Al3+. В центр полоски фильтровальной бумаги наносят 1–2 капли фильтрата, затем 1 каплю раствора HCl. Помещают полоску над склянкой с концентрированным раствором аммиака и держат ее 1–2 мин в парáх аммиака. Затем на пятно наносят каплю раствора ализарина и снова держат бумагу в парáх аммиака. Пятно окрашивается в фиолетовый цвет, характерный для ализарина в аммиачной среде. Бумагу подсушивают, наносят на пятно 1–2 капли раствора уксусной кислоты и снова подсушивают. При этом фиолетовая окраска ализарина исчезает. Если в пробе присутствуют ионы Al3+, то пятно становится розово-красным. 2.3. Анализ осадка Обнаружение Mn2+. Ионы Mn2+ открывают, действуя щавелевой кислотой на осадок MnО(OH)2. Проведению реакции мешает Fe(OH)3, поэтому его предварительно маскируют. Проведение реакции в отсутствие Fe(OH)3 К осадку после центрифугирования осторожно, по стенке пробирки пипеткой вводят 2 н. раствор Н2С2О4. В присутствии MnО(OH)2 образуется малиново-розовое комплексное соединение марганца H[Mn(C2O4)2]. Образующееся соединение неустойчиво, поэтому раствор перемешивать не следует. Проведение реакции в присутствии Fe(OH)3 К осадку добавляют несколько кристалликов NaF, а затем вводят Н2С2О4, как описано выше. Лабораторная работа № 3 Предварительные испытания Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной палочкой и сравнив полученную окраску с цветной шкалой. Проба на анионы I группы. К 2 каплям нейтрального или слабощелочного раствора (рН 7–8) добавляют 2–3 капли раствора BaCl2. Образование белого осадка указывает на присутствие анионов I группы. Проба на анионы II группы. К 2–3 каплям исследуемого раствора прибавляют 2–3 капли AgNO3. При этом может образоваться осадок, содержащий нерастворимые соли серебра с анионами I и II аналитических групп. К нему прибавляют несколько капель HNO3 для растворения солей, образованных анионами I группы: Ag2SO4¯ + 2HNO3 ® 2AgNO3 + Н2SO4 Ag2СO3¯ + 2HNO3 ® 2AgNO3 + СO2 + Н2O Ag3РO4¯ + 3HNO3 ® 3AgNO3 + Н3РO4 Если осадок не растворяется в азотной кислоте, то это указывает на присутствие анионов II группы. Проба на выделение газов. К небольшой порции анализируемого раствора добавляют несколько капель 2 н. раствора серной кислоты и наблюдают, выделяются ли пузырьки газа в момент ее приливания. Образование газа указывает на возможность присутствия Реакция является не очень чувствительной, поэтому даже при отсутствии аналитического эффекта необходимо провести характерные реакции на ионы Открытие анионов I группы Если предварительные испытания показали наличие анионов I группы, то проводят их осаждение групповым реагентом из отдельной порции анализируемого раствора объемом 1–2 мл, как при проведении пробы на анионы I группы. Осадок отделяют от раствора центрифугированием и проверяют полноту осаждения. Обнаружение сульфат-ионов. К полученному осадку прибавляют избыток соляной кислоты и тщательно перемешивают стеклянной палочкой. Если осадок не растворился полностью, то это указывает на присутствие сульфат-ионов. Одновременно необходимо зафиксировать, выделяются ли пузырьки газа при попытке растворения осадка. Обнаружение карбонат-ионов. Если растворение осадка в соляной кислоте сопровождается выделением пузырьков газа, то следует проверить присутствие карбонат-ионов по помутнению раствора Ba(OH)2. Реакцию проводят в специальном приборчике, представляющем собой пробирку, плотно закрытую пробкой с отверстием, в которое вставляется отводная трубка. На дно пробирки помещается анализируемый раствор, сюда же добавляют 2 н. раствор соляной кислоты, после чего пробирку плотно закрывают пробкой. Отводную трубочку быстро опускают в пробирку с раствором Ba(OH)2. В случае выделения CO2 баритовая вода мутнеет вследствие образования BaCO3. Обнаружение фосфат-ионов. В пробирку добавляют 2–3 капли раствора MgCl2, 2–3 капли 2 М раствора аммиака и столько же раствора хлорида аммония. Полученную магнезиальную смесь нагревают на водяной бане и добавляют к ней несколько капель анализируемого раствора. В случае присутствия фосфат-ионов выпадает белый кристаллический осадок MgNH4PO4. Открытие анионов II группы Обнаружение иодид-ионов. К отдельной порции анализируемого раствора прибавляют 2–3 капли 2 н. раствора серной кислоты и несколько капель бензола или хлороформа (органический слой будет сверху). Затем в эту же пробирку по одной капле добавляют хлорную воду, каждый раз хорошо взбалтывая ее содержимое. При наличии в растворе иодид-ионов появится фиолетовая окраска бензольного или хлороформного слоя за счет растворения I2. Если добавить слишком много хлорной воды, то окраска не появится из-за дальнейшего окисления I2 до иодноватой кислоты: I2 + 5Cl2 + 6H2О = 2HIO3 + 10HCl Обнаружение хлорид-ионов. К отдельной порции анализируемого раствора добавляют несколько капель 2 н. HNO3 до кислой реакции и несколько капель AgNO3. Образовавшийся осадок отделяют от раствора центрифугированием, промывают дистиллированной водой, после чего к нему добавляют 25%-ный раствор NH4OH. Тщательно перемешивают содержимое пробирки стеклянной палочкой. При наличии в растворе иодид-ионов осадок растворяется не полностью. Нерастворившийся осадок AgI отделяют центрифугированием и отбрасывают. Фильтрат помещают в другую пробирку и добавляют 3–4 капли раствора KBr. Появление обильной мутиAgBr указывает на присутствие в исследуемом растворе хлорид-ионов. Открытие анионов III группы Обнаружение нитрит-ионов. Характерную реакцию на Пробирочная реакция. К 2–3 каплям анализируемого раствора добавляют 1–2 капли 2 М HCl или CH3COOH и 2–3 капли раствора KI. Раствор буреет вследствие выделения I2. При добавлении 1–2 капель крахмала появляется темно-синяя окраска. Капельная реакция. На фильтровальную бумагу наносят последовательно каплю раствора крахмала, каплю 2 М CH3COOH и каплю раствора KI. Капля должна оставаться бесцветной. Вносят каплю анализируемого раствора. Если нитриты присутствуют, то появляется синяя окраска. Обнаружение нитрат-ионов. Обнаружению Проведение реакции в отсутствие В тщательно вымытую пробирку добавляют 3–4 капли анализируемого раствора, смачивая им стенки пробирки. Затем по стенке пробирки аккуратно пускают 1 каплю дифениламина, приготовленного на концентрированной серной кислоте (осторожно!). Появление интенсивной синей окраски указывает на присутствие Большие количества ионов I– могут помешать этой реакции за счет проявления побочного аналитического эффекта – коричневого окрашивания. Проведение реакции в присутствии NO 2 – К 4 каплям анализируемого раствора добавляют на кончике шпателя мочевину (карбамид), после чего в полученную смесь по каплям прибавляют 2–4 капли раствора H2SO4, перемешивая раствор стеклянной палочкой. Через некоторое время отдельную порцию испытывают на нитрит-ион реакцией с KI в присутствии крахмала. Только убедившись в полноте удаления Лабораторная работа № 4 Анализ смеси сухих солей Цель работы: провести анализ предложенной смеси сухих солей на содержание в ней катионов и анионов: – Проба А – смесь сухих солей, образованных катионами I и/или II аналитических групп и анионами различных групп; – Проба Б – смесь сухих солей, образованных катионами III аналитической группы и анионами различных групп. Сущность работы. В качестве контрольной задачи предлагается смесь сухих солей, в состав которой входят изученные ранее катионы и анионы. Поскольку анализ проводится «мокрым путем», то анализируемую смесь пpeждe всего необходимо растворить. При растворении смесей солей в воде могут протекать химические реакции между различными компонентами смеси. Например, при растворении смеси сухих солей Ba(NO3)2 и K3PO4 произойдет реакция осаждения: 3Ba2+ + 2PO43– ® Ba3(PO4)2¯ а при растворении смеси сухих солей FeCl3 и NaI – окислительно-восстановительная реакция: 2Fe3+ + 2I– ® 2Fe2+ + I2 Протекание этих реакций усложняет ход анализа, поэтому для выполнения лабораторной работы предлагается специально подобранная смесь сухих солей, полностью растворимая в воде. После перевода пробы в раствор проводят его анализ на наличие катионов и анионов. Катионы открывают, используя систематический ход анализа, а анионы – дробный. Анализ целесообразно начинать с обнаружения катионов, так как наличие некоторых из них свидетельствует об отсутствии ряда анионов. Следует учесть, что число открытых катионов и анионов может совпадать либо не совпадать. Например, в смеси солей KCl, NaCl, NH4Cl и MgCl2 присутствуют 4 катиона и 1 анион. Выполнение работы. Получают пробу для проведения анализа, записывают ее номер в лабораторный журнал. Описывают внешний вид пробы (окраска кристаллов, расплывание на воздухе). Растворяют пробу в дистиллированной воде, добавляя ее небольшими порциями и перемешивая раствор стеклянной палочкой. Большой объем воды использовать не следует, поскольку раствор будет сильно разбавленным, что усложнит анализ. Описывают внешний вид полученного раствора (окраска, прозрачность) и определяют значение рН с помощью универсальной индикаторной бумаги. Далее используют отдельные порции раствора для проведения предварительных испытаний, обнаружения катионов и анионов. Проба А. Смесь солей, образованных катионами I и/или II аналитических групп и анионами различных групп. Анализ проводят в следующем порядке: 1) предварительные испытания и систематический ход анализа катионов по методике, описанной в работе № 1; 2) вывод по результатам анализа катионов – каких анионов в смеси не может быть, учитывая, что смесь растворилась в воде без остатка; 3) предварительные испытания и дробный ход анализа анионов по методике, описанной в работе № 3. Если сделан вывод об отсутствии ряда анионов, то не следует проводить реакции с целью их обнаружения; 4) окончательный результат анализа. Проба Б. Смесь солей, образованных катионами III аналитической группы и анионами различных групп. Анализ проводят в следующем порядке: 1) предварительные испытания и систематический ход анализа катионов по методике, описанной в работе № 2; 2) вывод по результатам анализа катионов – каких анионов в смеси не может быть, учитывая, что смесь растворилась в воде без остатка; 3) предварительные испытания и дробный ход анализа анионов по методике, описанной в работе № 3, из которой должны быть исключены все операции с явно отсутствующими анионами; 4) окончательный результат анализа. А б Рис. 12. Весы: а – аналитические; б – технические Горизонтальное выравнивание весов проводится по встроенному уровню (рис. 13, а) вращением двух задних ножек. При этом пузырек воздуха устанавливается по центру встроенного уровня между двумя концентрическими окружностями (рис. 13, б).
аб Рис. 13. Горизонтальное выравнивание весов по встроенному уровню: а – вид встроенного уровня; б – правильное положение пузырька воздуха Включение весов осуществляется кратковременным нажатием клавиши «О/Т» (ON). На дисплее появится индикация массы: «0,00» (технические весы) или «0,0000» (аналитические в
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.250 (0.015 с.) |


 Минск 2012
Минск 2012

 Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной па
Определение реакции среды. Определяют значение рН раствора с помощью универсальной индикаторной бумаги, нанеся каплю раствора на полоску универсальной индикаторной бумаги стеклянной па  лочкой и сравнив полученную окраску с цветной шкалой.
лочкой и сравнив полученную окраску с цветной шкалой. Обнаружение
Обнаружение  . Реакцию проводят в «газовой камере», состоящей из двух часовых стекол одинакового размера. На нижнее стекло помещают 1–2 капли анализируемого раствора, 1–2 капли 2 н. раствора NaOH и накрывают другим стеклом, на вогнутую поверхность которого прикреплен кусочек влажной индикаторной бумаги (рис. 1). Посинение индикаторной бумаги свидетельствует о наличии в растворе ионов NH4+.
. Реакцию проводят в «газовой камере», состоящей из двух часовых стекол одинакового размера. На нижнее стекло помещают 1–2 капли анализируемого раствора, 1–2 капли 2 н. раствора NaOH и накрывают другим стеклом, на вогнутую поверхность которого прикреплен кусочек влажной индикаторной бумаги (рис. 1). Посинение индикаторной бумаги свидетельствует о наличии в растворе ионов NH4+. . Если образуется желтое окрашивание, то в растворе есть следовые количества ионов
. Если образуется желтое окрашивание, то в растворе есть следовые количества ионов 
 1. Микрокристаллоскопическая реакция с KH2SbO4. Каплю раствора, полученного после удаления ионов NH4+, выпаривают досуха на предметном стекле. Затем прямо на высохшую каплю наносят каплю раствора KH2SbO4. Если ионы Na+ присутствуют, то под микроскопом отчетливо видны бесцветные прозрачные кристаллы зернообразной формы (рис. 3). Кристаллы образуются в месте соединения капли реактива и высушенной капли. Часто кристаллы встречаются только в определенном месте капли и их нужно поискать. При выполнении этой реакции необходимо провести холостой опыт, т. к. в растворе самого реактива практически всегда под микроскопом заметны кристаллы. Они имеют другую форму, которая отличается от формы, приведенной на рис. 3.
1. Микрокристаллоскопическая реакция с KH2SbO4. Каплю раствора, полученного после удаления ионов NH4+, выпаривают досуха на предметном стекле. Затем прямо на высохшую каплю наносят каплю раствора KH2SbO4. Если ионы Na+ присутствуют, то под микроскопом отчетливо видны бесцветные прозрачные кристаллы зернообразной формы (рис. 3). Кристаллы образуются в месте соединения капли реактива и высушенной капли. Часто кристаллы встречаются только в определенном месте капли и их нужно поискать. При выполнении этой реакции необходимо провести холостой опыт, т. к. в растворе самого реактива практически всегда под микроскопом заметны кристаллы. Они имеют другую форму, которая отличается от формы, приведенной на рис. 3.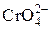 , [Al(OН)6]3– и [Zn(OН)4]2–, а осадок – гидроксиды Fe(OH)3 и MnО(OH)2.
, [Al(OН)6]3– и [Zn(OН)4]2–, а осадок – гидроксиды Fe(OH)3 и MnО(OH)2. или
или 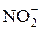 .
. и
и 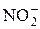 c иодидом в кислой среде можно выполнять разными способами.
c иодидом в кислой среде можно выполнять разными способами.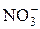 мешают анионы
мешают анионы 
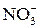 .
.




