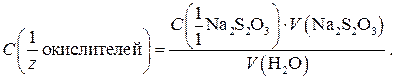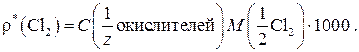Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Иодометрическое определение окислителей
Цель работы: определить иодометрическим методом: – проба А – массу меди(II) или соли CuSO4 ∙ 5H2O в пробе (г); – проба Б – массовую концентрацию «активного хлора» в водопроводной воде (мг Cl2/л). Сущность работы. В иодометрии применяют растворы восстановителей Na2S2O3 и KI, но прямое титрование ими окислителей невозможно, поскольку реакции между окислителями и Na2S2O3 идут нестехиометрично, а между окислителями и KI – медленно. Кроме того, раствор KI неустойчив и нет возможности зафиксировать к. т. т. при титровании этим раствором. Поэтому для определения окислителей используют титрование заместителя: окислитель замещают эквивалентным количеством
В качестве рабочего раствора используют стандартный раствор Na2S2O3, в качестве вспомогательных – растворы KI и Н2SO4. Специфический индикатор крахмал добавляют вблизи т. э. Определение Cu2+ основано на взаимодействии ионов Cu2+ с иодид-ионами и последующем титровании выделившегося иода стандартным раствором тиосульфата натрия: 2Cu2+ + 4I– = I2 + 2CuI↓
Значение стандартного потенциала пары I2/2I– (0,54 В) заметно превышает соответствующее значение пары Cu2+/Cu+ (0,16 В), поэтому окисление иодида ионами меди(II) представляется нереальным. Однако на самом деле реакция между Cu2+ и I– протекает количественно. Это обусловлено образованием малорастворимого осадка CuI, что существенно повышает потенциал пары Cu2+/Cu+. Реакцию следует проводить в кислой среде для подавления гидролиза ионов меди(II). Факторы эквивалентности веществ определяются на основании полуреакций: Cu2+ + е – = Cu+ Þ f экв(Cu2+) = 1
Определение «активного хлора». Под термином «активный хлор» понимают суммарное содержание в воде свободного хлора Cl2, хлорноватистой кислоты НСlO, гипохлорит-ионов СlO– и хлораминов NH2Cl, NHCl2, NCl3. При подкислении анализируемой воды и прибавлении к ней иодида калия все перечисленные вещества выделяют иод: Сl2 + 2I– = I2 + 2Сl– (6) СlO– + 2Н+ + 2I– = I2 + Сl– + Н2O НСlO + 2I– + Н+ = I2 + Сl– + Н2O NH2Cl + 2Н+ + 2I– = I2 + NH4+ + Cl– Выделившийся иод оттитровывают тиосульфатом натрия в присутствии крахмала. Содержание «активного хлора» выражают в мг/л в пересчете на хлор. Оборудование и реактивы: мерная колба, бюретка, пипетка Мора, мерные цилиндры (10–20 мл), коническая колба, часовые стекла.
Для анализа пробы А: стандартный 0,05 н. раствор Na2S2O3, Для анализа пробы Б: стандартный 0,01 н. или 0,005 н. раствор Na2S2O3, KI (крист.), 30%-ный раствор CH3COOН, 0,5%-ный раствор крахмала, ацетатный буферный раствор с рН = 4,5. Выполнение работы Проба А. Cu2+ или соль CuSO4 × 5H2O. Получают у лаборантов анализируемый раствор в мерную колбу, доводят объем дистиллированной водой до метки и тщательно перемешивают. Переносят пипеткой аликвотную часть раствора в коническую колбу, добавляют цилиндром 3 мл 2 н. раствора H2SO4 и 10–15 мл раствора KI. Накрыв колбу часовым стеклом, оставляют смесь в темноте на 5 мин для завершения реакции. В ходе реакции образуется I2, придающий раствору бурую окраску, и осадок CuI цвета слоновой кости, за счет чего раствор в колбе будет мутным. Выделившийся I2 начинают титровать тиосульфатом. Когда окраска раствора станет бледно-желтой, добавляют раствор крахмала до появления темно-синего окрашивания и продолжают титрование. В конечной точке титрования эта окраска исчезнет, в растворе останется только светлая муть (осадок CuI). По полученным данным рассчитывают массу меди(II) или соли CuSO4 × 5H2O в пробе (г). Проба Б. Определение «активного хлора». В коническую колбу, снабженную притертой стеклянной пробкой, наливают 50,00 или 100,00 мл анализируемой воды, вносят 0,5 г иодида калия и добавляют 10 мл уксусной кислоты. Через 5 мин оттитровывают выделившийся иод стандартным раствором тиосульфата натрия. В конце титрования прибавляют 1–2 мл раствора крахмала. При содержании «активного хлора» выше 1 мг/л используют 0,01 н. Na2S2O3, а при содержании от 0,1 до 1 мг/л – 0,005 н. Na2S2O3. По результатам титрования рассчитывают суммарную молярную концентрацию эквивалента хлорсодержащих соединений-окислителей в анализируемой воде:
Далее переходят к расчету массовой концентрации «активного хлора» в пересчете на хлор (мг Cl2/л):
Фактор эквивалентности Cl2 определяется по полуреакции
Лабораторная работа № 18
|
|||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 634; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.88.249 (0.008 с.) |


 Þ f экв(I2) =
Þ f экв(I2) = 
 Þ f экв(Na2S2O3) = 1
Þ f экв(Na2S2O3) = 1