
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ацидиметрическое определение карбонатов
Цель работы: определить массу (г) солей в анализируемом растворе: – проба А – Na2СО3; – проба Б – NaHСO3; – проба В – Na2СО3 и NaHСO3. Сущность работы. Угольная кислота является слабой двухосновной кислотой, имеющей рKа , 1 = 6,75 и рKа , 2 = 10,32. Согласно теории Бренстеда-Лоури ее анион – карбонат – является слабым двухкислотным основанием. Значения рKb , 1 и рKb , 2 для него рассчитываются по формулам:
Поскольку рKb , 2 – рKb , 1» 4, то Na2СО3 титруется ступенчато. Судя по значениям рKb , 1 и рKb , 2, на кривой титрования Na2СО3 будут наблюдаться два скачка, которые соответствуют последовательному протеканию реакций: Na2СО3 + HCl = NaHСO3 + NaCl NaHСO3 + HCl = H2O + СO2 + NaCl Карбонат натрия можно определять, титруя его либо по первой ступени (до NaHСO3), либо по двум сразу (до угольной кислоты). При этом используются разные индикаторы, различными оказываются и факторы эквивалентности Na2СО3. С фенолфталеином карбонат титруется по первой ступени: Na2СО3 + HCl = NaHСO3 + NaCl Þ f экв(Na2СО3) = 1 а в присутствии метилового оранжевого – по двум ступеням сразу: Na2СО3 + 2HCl = H2O + СO2↑ + 2NaCl Þ f экв(Na2СО3) = Переход окраски при титровании с метиловым оранжевым из щелочной среды в кислую (желтый → оранжевый) лучше воспринимается человеческим глазом, чем обесцвечивание малинового раствора при титровании с фенолфталеином. Гидрокарбонат натрия является амфолитом. Если титровать его кислотой, то он выступает в роли слабого основания, имеющего NaHСO3 + HCl = H2O + СO2 + NaCl Конечную точку титрования (к. т. т.) фиксируют с помощью индикатора метилового оранжевого. Смесь Na2СО3 и NaHСO3. Раздельное определение компонентов этой смеси основано на титровании щелочью с применением двух индикаторов при одном титровании (метод с фиксированием двух к. т. т.). Сначала анализируемый раствор титруют кислотой в присутствии фенолфталеина, при этом Na2СО3 оттитровывается до NaНСО3: Na2СО3 + HCl = NaHСO3* + NaCl и раствор обесцвечивается. В бесцветный раствор добавляют метиловый оранжевый и продолжают титровать кислотой. В этом случае титруются NaHСO3*, который образовался из Na2СО3, и NaHСO3, который первоначально содержался в растворе: NaHСO3* + HCl = H2O + СO2 + NaCl NaHСO3 + HCl = H2O + СO2 + NaCl Оборудование и реактивы: мерная колба, пипетка, бюретка, конические колбы, стандартный раствор HCl, индикаторы фенолфталеин, метиловый оранжевый.
Выполнение работы. В мерную колбу получают у лаборантов анализируемый раствор, доводят объем до метки дистиллированной водой, тщательно перемешивают и переносят аликвоту раствора в коническую колбу. Проба А. Na2СО3. Добавляют в колбу для титрования 1–2 капли выбранного индикатора – метилового оранжевого или фенолфталеина и проводят титрование стандартным раствором кислоты. Титрование с метиловым оранжевым прекращают, как только произойдет резкое изменение окраски раствора, а с фенолфталеином – как исчезнет розовая окраска. Титрование повторяют не менее 3 раз при условии, что D V ≤ 0,1 мл. По результатам титрования рассчитывают массу Na2СО3 в пробе (г). Проба Б. NaНСО3. Добавляют в колбу для титрования 1–2 капли индикатора метилового оранжевого и проводят титрование стандартным раствором кислоты. Титрование прекращают, как только произойдет резкое изменение окраски раствора. Титрование повторяют не менее 3 раз при условии, что D V ≤ 0,1 мл. По результатам титрования рассчитывают массу NaНСО3 в пробе (г). Проба В. Смесь Na2СО3 и NaHСO3. Добавляют в колбу для титрования 1–2 капли фенолфталеина и титруют HCl до исчезновения окраски индикатора. Делают отсчет по бюретке (V 1). В этот же раствор добавляют 1–2 капли метилового оранжевого и, не доливая рабочий раствор до нулевой отметки, продолжают титрование до изменения окраски раствора. Делают отсчет по бюретке (V 2). Титрование повторяют не менее 3 раз при условии, что D V ≤ 0,1 мл. По полученным результатам рассчитывают массу Na2СО3 и NaHСO3 в растворе (г).
Лабораторная работа № 12
Определение буферной емкости Цель работы: приготовить буферные растворы с заданным значением рН и определить их буферную емкость: – вариант 1 – ацетатный буферный раствор; – вариант 2 – аммиачный буферный раствор. Сущность работы. В ряде технологических процессов и при проведении анализов необходимо проводить исследования при постоянном значении рН. Для этих целей используются буферные растворы. Характерной особенностью буферных систем является их способность сохранять постоянное значение рН при разбавлении и при добавлении небольших количеств сильных кислот и оснований. Буферное действие прекращается, как только одна из составных частей буферного раствора полностью израсходуется. Например, на рис. 22 показана область буферного действия ацетатного буфера.
Рис. 22. Зависимость буферной емкости
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. Буферная емкость (π) – это число моль эквивалентов сильной кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу (понизить при добавлении кислоты и повысить при добавлении щелочи):
где где Количество моль-экв. кислоты или щелочи можно рассчитать по формуле
где Величина буферной емкости зависит от концентрации компонентов буферной смеси и отношения между этими концентрациями. С увеличением концентрации компонентов буферной смеси буферная емкость увеличивается. При разбавлении буферной смеси буферная емкость уменьшается. Буферная емкость максимальна при одинаковых концентрациях соли и кислоты или соли и основания в буферной смеси. Если молярные концентрации эквивалента кислоты и соли равны, то значение рН буферной смеси будет равно рKа. Следовательно, для приготовления буферной системы с наибольшей буферной емкостью надо выбирать кислоту с наиболее близкой к заданному значению рН величиной рKа. Для смесей, образованных слабым основанием и его солью, взятых в одинаковых концентрациях, рН = 14 – рKb, т. е. для их приготовления надо выбирать основание с рKb» 14 – рН. Оборудование и реактивы: мерныецилиндры (10 мл), мерные колбы (50,0 или 100,0 мл), воронка, пипетки (10,00–15,00 мл), бюретка, конические колбы для титрования, уксусная кислота 0,1 М, гидроксид натрия 1 М и 0,1 М, гидроксид аммония 0,2 М, соляная кислота 0,1 М, 0,2 М и 1 М, индикаторы метиловый оранжевый и фенолфталеин. Выполнение работы Вариант 1. Определение буферной емкости ацетатного 1. Приготовление буферных растворов. Получают у преподавателя задание из табл. 13.
Таблица 13 Задания для лабораторной работы
Рассчитывают соотношения и абсолютные значения объемов исходных растворов, необходимые для приготовления буферного раствора заданного объема с определенным значением рН, используя формулу для расчета рН буферного раствора, состоящего из слабой кислоты и ее соли. Раствором, объем которого меньше, ополаскивают бюретку, затем заполняют им бюретку. В мерную колбу приливают из бюретки необходимый объем этого раствора. Вторым раствором доводят объем буферной смеси до метки, используя воронку (последние 0,5–1 мл раствора прибавляют по каплям с помощью пипетки). Колбу плотно закрывают и перемешивают полученный раствор, переворачивая колбу несколько раз. 2. Определение буферной емкости ацетатного буфера по щелочи. Отбирают аликвоту 10,00 мл ацетатного буфера в колбу для титрования, добавляют 2 капли фенолфталеина (рТ = 9,0) и титруют стандартным раствором щелочи до появления неисчезающей розовой окраски. Титрование повторяют не менее 3 раз при условии, что D V ≤ 0,1 мл. По полученным результатам рассчитывают буферную емкость раствора. По указанию преподавателя разбавляют исходный буферный раствор в n раз и определяют его буферную емкость путем титрования. Сравнивают полученные значения буферной емкости. Вариант 2. Определение буферной емкости аммиачного 1. Приготовление буферных растворов. Получают у преподавателя задание из табл. 14. Таблица 14 Задания для лабораторной работы
Рассчитывают соотношения и абсолютные значения объемов исходных растворов, необходимые для приготовления буферного раствора заданного объема с определенным значением рН, используя формулы для расчета рН буферного раствора, состоящего из слабого основания и его соли. Раствором, объем которого меньше, ополаскивают бюретку, затем заполняют им бюретку. В мерную колбу приливают из бюретки необходимый объем этого раствора. Вторым раствором доводят объем буферной смеси до метки, используя воронку (последние 0,5–1 мл раствора прибавляют по каплям с помощью пипетки). Колбу плотно закрывают и перемешивают полученный раствор, переворачивая колбу несколько раз.
2. Определение буферной емкости аммиачного буфера по кислоте. Отбирают аликвоту 10,00 мл аммиачного буфера в колбу для титрования, добавляют 1–2 капли метилового оранжевого (рТ = 4,0) и титруют стандартным раствором кислоты до изменения окраски. Титрование повторяют не менее 3 раз при условии, что D V ≤ 0,1 мл. По полученным результатам рассчитывают буферную емкость раствора. По указанию преподавателя, разбавляют исходный буферный раствор в n раз и определяют его буферную емкость. Сравнивают полученные значения буферной емкости.
Лабораторная работа № 13 Определение солей аммония методом обратного титрования Цель работы: определить массу NН4Cl в пробе (г). Сущность работы. Ион аммония NН4Cl + NaOHизбыток = NН3↑ + Н2О + NаCl Остаток щелочи после реакции с NН4Cl титруют стандартным раствором кислоты: NaOHостаток + HCl = NaCl + Н2О Оборудование и реактивы: мерная колба, пипетка, бюретка, конические колбы, электрическая плитка, стандартные растворы NaOH (или KOH) и HCl, индикатор метиловый оранжевый, универсальная индикаторная бумага. Выполнение работы 1. Анализируемый раствор получают у лаборантов в мерную колбу и доводят объем до метки. В 2–3 конические колбы переносят одинаковые аликвоты раствора и добавляют в каждую из них пипеткой по два таких же объема стандартного раствора щелочи. 2. Растворы кипятят на плитке до полного удаления NН3. Полнотy удаления контролируют по универсальной индикаторной бумаге: смоченную дистиллированной водой бумажку вносят в пары над кипящим раствором. Если она не синеет, значит NН3 полностью удален. 3. Снимают колбы с плиток и охлаждают их до комнатной температуры. Добавляют в каждую колбу 1–2 капли метилового оранжевого и титруют раствором HCl до момента резкого изменения окраски раствора от желтой к оранжевой. 4. По полученным данным находят массу NН4Cl в пробе, г.
Лабораторная работа № 14
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1005; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.212.145 (0.031 с.) |

 .
. При титровании протекает реакция
При титровании протекает реакция ;
· Na2СО3 и NaHСO3 кислотой (при анализе пробы В) с использованием кнопки Добавить для сравнения и переходом к сводному графику на листе Моделирование.
Объяснить вид полученных кривых и обосновать использование индикаторов метилового оранжевого и фенолфталеина, в т. ч. при титровании смеси карбонатов.
2. С использованием ПО «Практикум по АХ и ФХМА»:
– оценить неопределенность измерений;
– провести Q -тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений.
;
· Na2СО3 и NaHСO3 кислотой (при анализе пробы В) с использованием кнопки Добавить для сравнения и переходом к сводному графику на листе Моделирование.
Объяснить вид полученных кривых и обосновать использование индикаторов метилового оранжевого и фенолфталеина, в т. ч. при титровании смеси карбонатов.
2. С использованием ПО «Практикум по АХ и ФХМА»:
– оценить неопределенность измерений;
– провести Q -тест и статистическую обработку результатов анализа, если имеется 4 и более результатов параллельных измерений.


 – количество моль-экв. кислоты или щелочи; ΔрН – изменение рН после добавления кислоты или щелочи; V – объем буферного раствора, л.
– количество моль-экв. кислоты или щелочи; ΔрН – изменение рН после добавления кислоты или щелочи; V – объем буферного раствора, л.
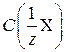 – молярная концентрация эквивалента кислоты (щелочи), моль/л; V (X) – объем раствора кислоты (щелочи), л.
– молярная концентрация эквивалента кислоты (щелочи), моль/л; V (X) – объем раствора кислоты (щелочи), л. является очень слабой кислотой (р Kа = 9,25), поэтому скачок на кривой титрования его щелочью отсутствует и прямое титрование провести невозможно. Чаще всего соли аммония определяют методом обратного титрования. К раствору добавляют заведомо избыточный, но точно отмеренный объем стандартного раствора щелочи:
является очень слабой кислотой (р Kа = 9,25), поэтому скачок на кривой титрования его щелочью отсутствует и прямое титрование провести невозможно. Чаще всего соли аммония определяют методом обратного титрования. К раствору добавляют заведомо избыточный, но точно отмеренный объем стандартного раствора щелочи:



