
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы химического анализа воды при гидрогеологических исследованиях. Химические классификации типов подземных водСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Химический анализ природных вод в практике гидрогеологических работ предусматривает следующие задачи: а) изучение закономерностей формирования и распространения природных вод различного состава; б) исследование природных вод как поискового критерия на месторождения полезных ископаемых – нефти, газа, солей, меди, свинца, молибдена и др.; в) оценка природных вод как химического сырья для получения иода, брома, бора, меди и других веществ; г) оценка состава и свойств природных вод для питьевого, технического, сельскохозяйственного, лечебного и других видов использования. Для общей характеристики состава и свойств воды применяют три типа анализа воды – полевой, сокращенный и полный. Полевой анализ включает определение физических свойств, pH, Cl-, SO42-, NO3-, HCO3-, СO32-, Ca2+, Mg2+, Fe2+, CO2, H2S, O2. Вычисляются Na+ + K+, Mg2+ или Ca2+, карбонатная жесткость, сумма минеральных веществ. Полевой анализ производится в полевых условиях с помощью походной лаборатории. Применяется при массовых определениях для предварительных характеристик вод изучаемого района. Сокращенный анализ включает определение физических свойств, pH, Cl-, SO42-, NO3-, HCO3-, СO32-, Ca2+, Mg2+, Fe2+, Fe3+, NH4+, NO2-, H2S, CО2, H2SiО3, окисляемости, сухого остатка. Вычисляются Na+ + К+, жесткость общая, карбонатная, СО2 агрессивная. Сокращенный анализ производится более точными методами в стационарной лаборатории. Он позволяет произвести контроль анализа. Применяется при массовых определениях для характеристики вод района. Полный анализ включает определение физических свойств, pH, Cl -, SO42-, NO3-, HCO3-, СO32-, Na+, К+, Са2+, Mg2+, Fe2+, Fe3+, NH4+, NO2-, H2S, CО2, H2SiО3, окисляемости, сухого остатка. Вычисляются.жесткость общая, карбонатная, СО2 агрессивная. Полный анализ производится наиболее точными методами в стационарной лаборатории. Позволяет произвести контроль определений по сухому остатку и по суммам миллиграмм-эквивалентов катионов и анионов. При проведений специальных исследований необходимы определения состава спонтанных и растворенных газов. В газах определяются: H2S + СО2,О2, СН4, N2 +- редкие, Аr + Кr + Хе, Не + Ne и тяжелые углеводороды. Гидрохимический метод поисков н разведки полезных ископаемых вызывает необходимость определений Li, Rb, Cs, Ва, Вr, I, F, Р, As, В, Сu, Pb, Zn, Cd, Ni, Со, V, Ra, Rn, органических веществ и т. д.
Разноообразие химического состава природных вод вызывает необходимость их систематизации и классификации. Ниже приводится краткое описание некоторых распространенных классификаций. Классификация Пальмера по соотношению анионов и катионов. Классификация построена по принципу соотношения различных групп анионов и катионов, обусловливающих характерные свойства природных вод. Выделяются пять групп катионов и анионов и шесть характерных свойств воды. Данные анализа выражаются в процент-эквивалентной форме. Катионы и анионы, близкие по своим химическим свойствам, объединяются в следующие группы: Группа а – сумма процент-эквивалентов катионов щелочных металлов (Na++ К++ Li+). Группа е – сумма процент-эквивалентов катионов щелочноземельных металлов (Са2+ + Mg2+ + Ва2+). Группа S – сумма процент-эквивалентов анионов сильных кислот (SO42-+ Cl- + NO3-) Группа А – сумма процент-эквивалентов аиионов слабых кислот (СО32- + HCO3- + HS- + HSiO3-). Группа т – сумма процент-эквивалентов водород-иона и катионов тяжелых металлов (Н+ + Fe2+ + Fe3+ + Сu2+ и др.). Характерные свойства воды, определяемые присутствующими в водах группами ионов, подразделяются на шесть следующих сочетаний:
На рис. 5.1 изображена схема свойств воды, иллюстрирующая шесть характеристик Пальмера. По соотношению различных катионов и аниоиов (в процент-эквивалентах) выделяется, по Пальмеру, пять классов вод. I. Сумма анионов сильных кислот меньше суммы катионов щелочных металлов: S < а. II. Сумма анионов сильных кислот равна сумме катионов щелочных металлов: S = а.
III. Сумма анионов сильных кислот больше суммы катионов щелочных металлов, но меньше суммы катионов щелочных и щелочноземельных металлов: (а + е) > S > а. IV. Сумма анионов сильных кислот равна сумме катионов щелочных и щелочноземельных металлов: S = (а + е). V. Сумма аиионов сильных кислот больше суммы катионов щелочных и щелочноземельных металлов: S > (а+ е).
Рис. 5.1. Схема химических свойств воды
Каждый из этих классов характеризует не более чем четыре свойства воды (табл. 5.1). I класс – воды щелочные, образующиеся при растворении продуктов выветривания изверженных пород в результате процессов обменной адсорбции кальция на натрий. Характерны для вод нефтяных месторождений. II класс – промежуточный между классами I и III III класс – воды с постоянной и временной жесткостью. Воды коры выветривания. IV класс – воды только с постоянной жесткостью. Содержат преимущественно хлориды и сульфаты щелочных металлов. Воды морей и соленых озер. V класс – кислые воды. Содержат сульфаты железа, алюминия и тяжелых металлов. Воды окисленной зоны рудных месторождений. Пересчет результатов анализа вод, по Пальмеру, производится путем комбинирования процент-эквивалентов катионов и анионов по вышеизложенному принципу. Ниже приводится пример пересчета данных анализа воды, приведенных в табл. 5.2. Таблица 5.1 Свойства воды в каждом из пяти классов, по Пальмеру
Таблица 5.2 Анализ воды
Пример расчета.
Вода, таким образом, должна быть отнесена к I классу.
Для графического изображения классификации вод по Пальмеру используется график (рис. 5.2), представляющий собой три равных горизонтальных столбика, каждый из которых разделен на 100 равных частей. На верхнем столбике откладывают процент-эквиваленты катионов (K+ + Na+, Mg2++ Са2+, Fe2+, Mn3+ и других тяжелых металлов), на нижнем – процент-эквиваленты анионов (SO42-, Cl-, NO3-, СО32- + HCO3-). На среднем столбике откладывают характерные свойства воды.
Задание 1. и По данным результатов анализа воды (прилож. 4) определить её класс (по Пальмеру) построить график состава.
Рис. 5.2. График пяти классов воды, по Пальмеру
Нумерация природных вод, по Н. И. Толстихину. Классификация Н.И. Толстихина, известная под названием «Нумерация природных вод», не только выделяет некоторые группы, но и охватывает все разнообразие вод, встречающихся в природе. Сущность нумерации заключается в том, что вычисленные в процент-эквивалентах группы катионов и анионов наносят на диаграмму, изображенную на рис. 5.3. Диаграмма представляет собой квадрат, который разделен на десять вертикальных и десять горизонтальных рядов, образующих сто малых квадратов. Каждый имеет свой номер. Для определения номера воды поступают следующим образом. На горизонтальной стороне квадрата слева направо откладывают сумму процент-эквивалентов Са2+ + Mg2+ + Fe2+ или справа налево – сумму процент- эквивалентов Na+ + К+. На вертикальной стороне снизу вверх откладывают сумму процент-эквивалентов СО32- + HCO3- или сверху вниз — сумму процент- эквивалентов SO42-+ Cl-. Точка пересечения ординаты и абсциссы указывает на состав данной воды. Вода получает номер того малого квадрата, в который попадает точка ее анализа.
Рис. 5.3. График-квадрат нумерации природных вод, по Н. И. Толстихину
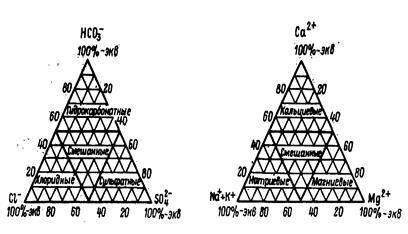
Определить номер воды можно и арифметическим путем. Для этого округляют единицы процент-эквивалентов группы Na+ + К+ до полного десятка и полученное число десятков складывают с процент-эквивалентами группы SO42-+ Cl-. При этом, если последняя группа окажется однозначным числом, она в расчет не принимается. Пример расчета. Группа Na+ + К+ равна 54, число принимается равным 6. Группа SO42-+ Cl- равна 49, число принимается равным 5. В приводимом примере вода по графику (рис. 5.3) будет иметь № 46. В нем группа Na+ + К+ равна 18,50+ 3,78= 22,28 и число десятков в этой группе принимается равным 3. Группа SO42-+ Cl- представлена однозначным числом 4,52 и в расчет не принимается. На основании номера воды можно судить о сумме процент-эквивалентов групп а, е, S, А по принадлежности воды к I, II, III и IV классам Пальмера. Номер воды не характеризует количества SO42-и Cl-, а дает их сумму. Н. И. Толстихин рекомендует устранить этот недостаток путем написания за номером воды количества процент-эквивалентов SO42. Как дополнение к нумерации вод представляет интерес составление графиков-треугольников отдельно для катионов и анионов (рис. 5.4).
Рис. 5.4. Графики-треугольники для катионов и анионов
Для газов Н. И. Толстихиным предложен график-треугольник, стороны которого разделены на 100 частей (рис. 5.5). Применение последнего сходно с применением графика-квадрата. Большое сходство с квадратом Н. И. Толстихина, дополненным треугольниками анионного и катионного состава, имеет графическое изображение состава воды в виде ромба с треугольниками катионного и анионного состава, опубликованное С. Девисом, Р. де Уистом и показанное на рис. 3.16. Характерно, что химический состав воды на данном рисунке называется в последовательности: катион – анион, в российской литературе воду называют в обратном порядке.
Рис. 5.5. График-треугольник для газов
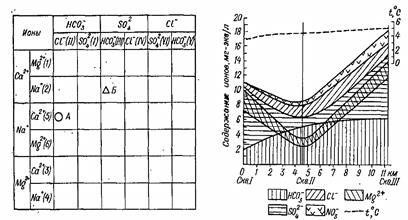
Задание 2. По данным результатов анализа воды (прилож. 4) определить её номер (по Н. И. Толстихину). График-квадрат А. А. Бродского. На графике (рис. 5.6а) по оси абсцисс откладывают первые и вторые по преобладанию катионы. Результаты каждого анализа наносят в один из 36 квадратов графика. Таким образом, в каждом квадрате представлен определенный тип воды. Химический состав воды наносят на график не в виде точки, а в виде значка, отображающего ту или иную степень минерализации. Для обобщения различных вод большого региона вводят условные обозначения – значки и индексы в виде букв. При применении условных обозначений любая вода может быть охарактеризована не только посредством наглядного изображения на графике, но и при помощи полного индекса, указывающего ее местоположение в том или ином квадрате. В прилагаемой табл. 11 вода А имеет индекс II5А, вода Б – III2Б.
Рис. 5.6. Классификация воды по содержанию ионов (в %-экв), по С. Денису и Р. де Уисту: А – кальцево-карбонатная; В – кальциево-натриево-хлоридная вода; С – натриево-кальциево-магниево-сульфатная вода
Гидрохимический профиль, по А. А. Бродскому. Гидрохимический профиль строят следующим образом. По оси абсцисс (рис. 5.7б) откладывают в определенном масштабе расстояния между точками взятия проб воды. Для изучения изменения состава воды во времени или с глубиной на этой же оси вместо расстояния можно откладывать время или глубину отбора проб. По оси ординат, откладывают содержание ионов в миллиграмм-эквивалентах. В начале наносят в определенном порядке анионы. Первые точки от нуля ставят для гидрокарбонат-иона и соединяют между собой кривой. Площадь, образованную этой кривой и осью абсцисс, штрихуют согласно условным обозначениям. Затем откладывают точки дли сульфат-иона и в той же последовательности – для хлорид-иона. При наличии в воде нитрат-иона он также выделяется на профиле, но уже выше линии хлорид-иона. Таблица 5.3 Химический состав вод А и Б
Примечание. Кроме того, вода Б содержит 1300 мг/л СО2, рН = 6,5 и имеет температуру 40оС. Дебит данного водоисточника 1000 л/сутки.
Все эти точки также соединяют между собой кривыми, а площади между кривыми соответственно штрихуют. На профиль, образованный анионами, таким же образом наносят катионный состав в последовательности: Са2+ –Mg2+–Na+–К+. При этом заштриховывают только площадь, соответствующую ионам магния. Так как суммы миллиграмм-эквивалентов анионов и катионов всегда равны, то в любом месте графика кривая нитрат-иона (или, при его отсутствии, кривая хлорид-иона) совпадает с кривой щелочных металлов.
На рис. 5.7б скв. II и III расположены от скв. I на расстоянии соответственно 4,5 и 11,3 км. Скв. I имеет воду с содержанием (мг-экв/л): HCO3- – 2,0; SO42- – 8, Cl- – 1,0; NO33-– нет; Ca2+ – 7,0; Mg2+ – 2,6; Na+ – 1,4. Скв. II содержит воду А, а скв. III — воду Б. На гидрохимическом профиле четко отображены не только соотношения между ионами в каждом отдельном водопункте, но и гипотетические соли, образующие эти ионы, и, самое главное, изменение ионного состава. В тех случаях, когда гидрохимический профиль применяется для выяснения пространственных изменений, он обязательно совмещается с соответствующим гидрогеологическим профилем или разрезом. Выражение химического состава воды в виде формул. Из формул наибольшей популярностью пользуются формула Курлова и формула солевого состава воды.
а б Рис. 5.7. График-квадрат (а) и гидрохимический профиль (б) по А.А. Бродскому
Формула Курлова представляет собой псевдодробь, в числителе которой находятся анионы (%-экв) в убывающем порядке их содержания, а в знаменателе – в таком же порядке катионы. Для вычисления процент-эквивалентов (% - экв) принимаем сумму мг - экв анионов (ХА), содержащихся в 1 л воды за 100 % и вычисляем процент содержания каждого аниона в мг - экв по отношению к этой сумме. Аналогично вычисляем %- экв катионов. Ионы, присутствующие в количестве менее 10%-экв, в формуле не указывают. Формула сопровождается дополнительными данными. Слева от дроби проставляют величину рН, жесткость (ж)(в мг-экв/л), в граммах на литр количество газов и активных элементов при содержании их не менее нижних норм, отличающих обычные воды от минеральных, и минерализация воды М в граммах до первого десятичного знака. Справа от дроби проставляется температура воды Т и дебет Д в литрах в сутки. Так, вода Б будет обозначаться следующей формулой:
SO447 HCO334 Cl10
Ca66 Na18 Mg14
Формула солевого состава отличается от формулы Курлова тем, что в ней отображено только содержание основных ионов, без указания температуры, дебета, рН и жесткости. Она часто используется в случае большого количества анализов воды, для упрощения обработки результатов. Задание 3. Составить формулы Курлова и солевого состава для трех проб воды. Варианты для выполнения задания представлены в прилож. 3. В каждом варианте принять шаг по дебету скважины 1,0 л/сут, исходное значение по дебету 2 л/сут. Температура для 1-й воды 30ºС; 2-й – 45ºС; 3-й 20ºС.
Практическая работа № 6
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 2173; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.63.186 (0.015 с.) |







 pH 6,5 ж 14,89 СО2М 1,4 Т40Д1000
pH 6,5 ж 14,89 СО2М 1,4 Т40Д1000


