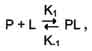Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осаждение белка солями тяжелых металлов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Белки при взаимодействии с солями свинца, меди, ртути, серебра и других тяжелых металлов денатурируются и выпадают в осадок. Однако при избытке некоторых солей наблюдается растворение первоначально образовавшегося осадка. Это связано с накоплением ионов металла на поверхности денатурированного белка и появлением положительного заряда на белковой молекуле. Реактивы: 1) яичный белок, 1% раствор; 2) сульфат меди, 10% раствор; 3) ацетат свинца, 5% раствор; 4) нитрат серебра, 5% раствор. 14
Классификация белков в зависимости от выполняемых функций:
16. Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25). Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом. 1. Характеристика активного центра Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра. Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот. В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным. Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85). Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование. Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов. 2. Многообразие лигандов
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2).
Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него. Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
Рис. 1-26. Связывание гексокиназы с глюкозой. 3. Сродство активного центра лиганду Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда. Константа диссоциации - характеристика сродства активного центра лиганду. · Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL. Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия: [P] [L] K1 = [PL] K-1. Отсюда: KДИСС=K-1/K1=[P]*[L] / [PL]. Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь. Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации. Ксв =1/Kдисс=[PL] / [P]*[L]. Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость. Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка · При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [PL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [PL]/[P0]?100 (где Р0 - концентрация белка до добавления лиганда).
· При полунасыщении белка лигандом концентрации [PL] и [Р] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т.е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому по кривой насыщения можно найти Кдисс и оценить сродство данного белка лиганду. Зависимость между образованием комплекса [PL] и концентрацией белка при избытке лиганда · Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [PL]. Однако, если увеличивать концентрацию белка, то количество [PL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [PL] можно регистрировать, например
Рис. 1-27. График насыщения белка лигандом. · с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
17/ В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр). Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
19.Четвертичная структура белков Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным. 1. Количество протомеров в структуре В состав олигомерных белков может входить от двух до нескольких десятков протомеров, хотя наиболее часто встречают белки, содержащие от двух до четырёх полипептидных цепей (димерные, тетрамерные белки).Так, фермент гексокиназа содержит в своём составе 2 протомера; белок эритроцитов гемоглобин и фермент лактатдегидрогеназа - 4 протомера; Некоторые олигомерные белки содержат идентичные протомеры (например, гексокиназа), другие состоят из разных протомеров. Олигомерные белки имеют большую молекулярную массу. Белки с молекулярной массой более 50 000 Д практически всегда содержат несколько мономерных полипептидных цепей. По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции. 2. Сборка протомеров в олигомерный белок. "Узнавание" и присоединение отдельных протомеров олигомерного белка происходят благодаря формированию на их поверхности контактных участков. Последние состоят из радикалов аминокислот, собранных в данном месте в процессе образования третичной структуры белка. Совокупность этих радикалов формирует уникальные поверхности, способные с высокой специфичностью объединяться друг с другом. Таким образом, взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул. Кооперативность Кооперативное связывание Когда субстрат связывается с активным центром одной субъединицы фермента, остальные субъединицы активируются. Лиганды могут иметь некооперативный, положительный или отрицательный кооперативный эффект. ( Примером положительной кооперативности может служить связывание кислорода гемоглобином.)Отрицательная кооперативность означает противоположное — в момент связывания лиганда белком, сродство белка к лиганду снижается. Примером может служить взаимодействие между глицеральдегид-3-фосфатом и ферментом глицеральдегид-3-фосфат дегидрогеназой. Кооперативность, явление кооперативности — это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность). Таким образом, сила взаимодействия атомов или молекул возрастает по мере нарастания изменений в системе, делая их коллективно согласованными 3. ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА. Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин - мономерный белок, а гемоглобин - тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1299; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.186.95 (0.016 с.) |