Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Как формируется молекула белка.Содержание книги
Поиск на нашем сайте
Белок – это последовательность аминокислот, связанных друг с другом пептидными связями. Если количество аминокислот не превышает 10, то такое соединение называется пептид; если от 10 до 40 аминокислот – полипептид, если более 40 аминокислот – белок.
Схематичное представление последовательности Главное в белке - последовательность аминокислот
Участок белковой цепи длиной в 6 аминокислот (Сер-Цис-Тир-Лей-Глу-Ала)
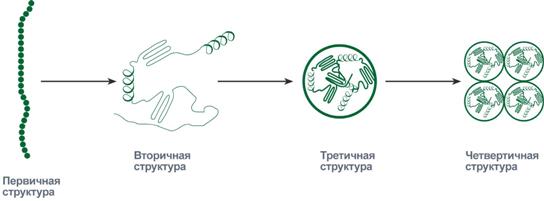
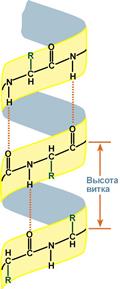
Вторичная структура белка двояка
β-Складчатый слой
Укладка белка в виде β-складчатого слоя Свертывание белка в глобулу Третичная структура.
Схематичное представление укладки белка в третичную структуру Связи: · водородные – между ОН-, СООН-, NH2-группами радикалов аминокислот, · дисульфидные – между остатками цистеина, · гидрофобные – между остатками алифатических и ароматических аминокислот, · ионные – между СОО–-группами глутамата и аспартата и NH3+-группами лизина и аргинина, · псевдопептидные – между дополнительными СОО–-группами глутамата и аспартата и дополнительными NH3+-группами лизина и аргинина. Четвертичная структура белка представлена олигомерами их индивидуальные цепи – протомерами (мономерами, субъединицами)
Например, гемоглобин – белок эритроцитов, переносящий кислород, состоит из 4 субъединиц – 2 α-субъединицы и 2 β-субъединицы в гемоглобине взрослых, 2 α-субъединицы и 2 γ-субъединицы в фетальном гемоглобине. Лактатдегидрогеназа – фермент, принимающий активное участие в окислении глюкозы при мышечном сокращении, также включает 4 субъединицы – Н (heart) и М (muscle) в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4. Всего 5 изоферментов. Креатинкиназа – фермент, участвующий в регенерации АТФ при мышечном сокращении, состоит из 2 субъединиц – В (brain) и М (muscle) в разных сочетаниях: ВВ, ВМ, ММ. Всего 3 изофермента.
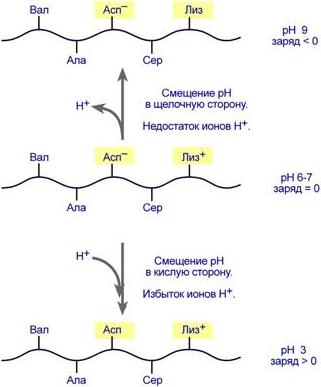
Схема кооперативного взаимодействия субъединиц в гемоглобине Свойства белков следуют из их строения Амфотерность Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Влияние рН на заряд белка
Изменение заряда белковой цепи при изменении pH Растворимость
Растворимость объясняется: · наличием заряда и взаимоотталкиванием заряженных молекул белка, · наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Классификация по функции В соответствии с биологическими функциями выделяют: · структурные белки (коллаген, кератин), · ферментативные (пепсин, амилаза), · транспортные (трансферрин, альбумин, гемоглобин), · пищевые (белки яйца, злаков), · сократительные и двигательные (актин, миозин, тубулин), · защитные (иммуноглобулины, тромбин, фибриноген), · регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).
Классификация по строению
Простые белки немногочисленны Структура простых белков представлена только полипептидной цепью (альбумин, инсулин). Однако необходимо понимать, что многие простые белки (например, альбумин) не существуют в "чистом" виде, они всегда связаны с какими-либо небелковыми веществами. Их относят к простым белкам только по той причине, что связи с небелковой группой слабые. Альбумины Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 445; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.57.239 (0.01 с.) |





 Строение тетрамера гемоглобина взрослых
Строение тетрамера гемоглобина взрослых