Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение протеиногенных аминокислотСодержание книги
Поиск на нашем сайте
Аминокислоты обладают изомерией
Изомерия аминокислот в зависимости от положения аминогруппы
α- и β- формы аланина Для организма млекопитающих наиболее характерны α-аминокислоты.
Изомерия по абсолютной конфигурации
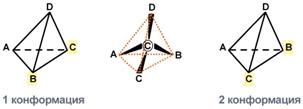
Две конформации тетраэдра В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.
L- и D-формы аланина
Деление изомеров по оптической активности
Право- и левовращающие формы аланина Для аминокислот характерна амфотерность § ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин), § ИЭТ кислых аминокислот - для глутамата 3,2, для аспартата 2,8, § ИЭТ основных аминокислот - для гистидина 7,6, для аргинина 10,8, для лизина 9,7. Заряд аминокислот зависит от величины рН среды и от строения их радикала. Если рН ниже ИЭТ – заряд аминокислоты становится положительным, если рН выше – отрицательным.
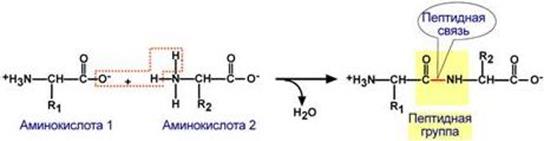
Изменение заряда аминокислот при смещении рН раствора Аминокислоты соединяются пептидной связью
Свойства пептидной связи: 1. Копланарность
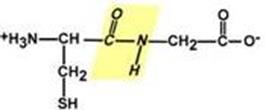
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Транс-положение заместителей
Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении. Две равнозначные формы
. 4. Способность к образованию водородных связей.
Пептидная связь имеет частично характер двойной связи.
Белки Функции белков Структурная функция - формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны; - участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности); - участие в создании органелл – рибосомы. Ферментативная функция - все ферменты являются белками; - рибозимы - рибонуклеиновые кислоты, обладающие каталитической активностью. Гормональная функция Регуляцию и согласование обмена веществ в разных клетках организма. Часть из них являются белками, например, инсулин и глюкагон. Рецепторная функция - избирательное связывание гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная функция - только белки осуществляют перенос веществ в крови: липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа). - транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. - транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры. Резервная функция - депонированного белка - производство и накопление в яйце яичного альбумина; - у животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная функция Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитная функция - иммуноглобулины крови - предупреждение инфекционного процесса; - факторы системы комплемента, пропердин; - при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин; - протеогликаны - механическая защита и поддержка клеток, К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови. - белковая буферная система участвует в регуляции кислотно-щелочного состояния.
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 356; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.82.22 (0.008 с.) |