Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Двадцать аминокислот необходимы для синтеза белкаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
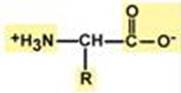
Лекция 1 Аминокислоты. Белки http://biokhimija.ru/aminoikislota/peptidnaja-svjaz.html Аминокислоты
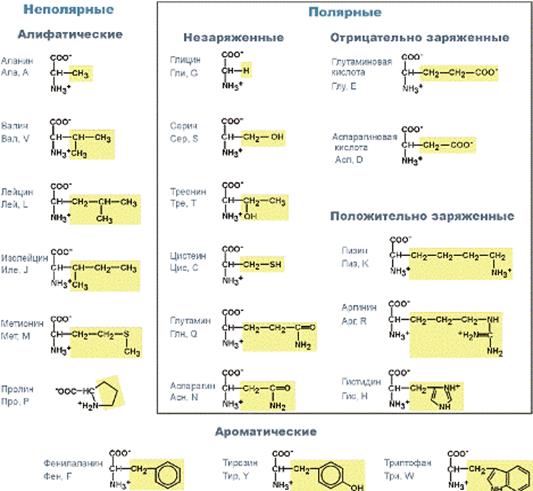
Двадцать аминокислот необходимы для синтеза белка По строению бокового радикала: · алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин), · ароматические (фенилаланин, тирозин, триптофан), · серусодержащие (цистеин, метионин), · содержащие ОН-группу (серин, треонин, опять тирозин), · содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты), · дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
Строение протеиногенных аминокислот Аминокислоты обладают изомерией
Изомерия аминокислот в зависимости от положения аминогруппы
α- и β- формы аланина Для организма млекопитающих наиболее характерны α-аминокислоты.
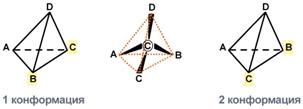
Изомерия по абсолютной конфигурации
Две конформации тетраэдра В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.
L- и D-формы аланина
Деление изомеров по оптической активности
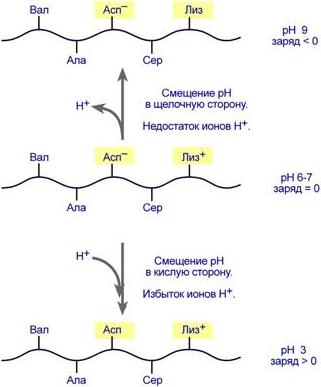
Право- и левовращающие формы аланина Для аминокислот характерна амфотерность § ИЭТ большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин), § ИЭТ кислых аминокислот - для глутамата 3,2, для аспартата 2,8, § ИЭТ основных аминокислот - для гистидина 7,6, для аргинина 10,8, для лизина 9,7. Заряд аминокислот зависит от величины рН среды и от строения их радикала. Если рН ниже ИЭТ – заряд аминокислоты становится положительным, если рН выше – отрицательным.
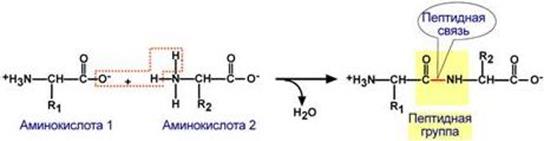
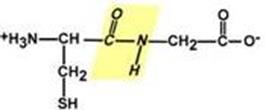
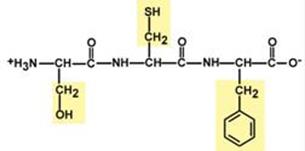
Изменение заряда аминокислот при смещении рН раствора Аминокислоты соединяются пептидной связью
Свойства пептидной связи: 1. Копланарность
Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи. Транс-положение заместителей
Радикалы аминокислот по отношению к оси C-N связи находятся по "разные" стороны, в транс-положении. Две равнозначные формы
. 4. Способность к образованию водородных связей.
Пептидная связь имеет частично характер двойной связи.
Белки Функции белков Структурная функция - формируют вещество соединительной ткани – коллаген, эластин, кератин, протеогликаны; - участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности); - участие в создании органелл – рибосомы. Ферментативная функция - все ферменты являются белками; - рибозимы - рибонуклеиновые кислоты, обладающие каталитической активностью. Гормональная функция Регуляцию и согласование обмена веществ в разных клетках организма. Часть из них являются белками, например, инсулин и глюкагон. Рецепторная функция - избирательное связывание гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Транспортная функция - только белки осуществляют перенос веществ в крови: липопротеины (перенос жира), гемоглобин (транспорт кислорода), трансферрин (транспорт железа). - транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. - транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры. Резервная функция - депонированного белка - производство и накопление в яйце яичного альбумина; - у животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени. Сократительная функция Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин). Защитная функция - иммуноглобулины крови - предупреждение инфекционного процесса; - факторы системы комплемента, пропердин; - при повреждении тканей работают белки свертывающей системы крови - например, фибриноген, протромбин, антигемофильный глобулин; - протеогликаны - механическая защита и поддержка клеток, К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
- белковая буферная система участвует в регуляции кислотно-щелочного состояния. Свертывание белка в глобулу Третичная структура.
Амфотерность Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Влияние рН на заряд белка
Растворимость
Растворимость объясняется: · наличием заряда и взаимоотталкиванием заряженных молекул белка, · наличием гидратной оболочки – чем больше полярных и/или заряженных аминокислот в белке, тем больше гидратная оболочка. Классификация по функции В соответствии с биологическими функциями выделяют: · структурные белки (коллаген, кератин), · ферментативные (пепсин, амилаза), · транспортные (трансферрин, альбумин, гемоглобин), · пищевые (белки яйца, злаков), · сократительные и двигательные (актин, миозин, тубулин), · защитные (иммуноглобулины, тромбин, фибриноген), · регуляторные (соматотропный гормон, адренокортикотропный гормон, инсулин).
Классификация по строению
Альбумины Альбумины – это группа схожих белков плазмы крови с молекулярной массой около 40 кДа, содержат много глутаминовой кислоты и поэтому имеют кислые свойства и высокий отрицательный заряд при физиологических рН. Легко адсорбируют полярные и неполярные молекулы, являются, белком-транспортером в крови для многих веществ, в первую очередь для билирубина и длинноцепочечных жирных кислот. Глобулины Группа разнообразных белков плазмы крови с молекулярной массой до 100 кДа, слабокислые или нейтральные. При электрофорезе глобулины сыворотки крови разделяются, как минимум, на 4 фракции – α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины.
Синтез коллагена Эластин
Строение десмозина
Этапы организации хроматина Гликопротеины
Протеогликаны
Гемопротеины
Строение гема Лекция 1 Аминокислоты. Белки http://biokhimija.ru/aminoikislota/peptidnaja-svjaz.html Аминокислоты
Двадцать аминокислот необходимы для синтеза белка По строению бокового радикала: · алифатические (аланин, валин, лейцин, изолейцин, пролин, глицин), · ароматические (фенилаланин, тирозин, триптофан), · серусодержащие (цистеин, метионин), · содержащие ОН-группу (серин, треонин, опять тирозин), · содержащие дополнительную СООН-группу (аспарагиновая и глутаминовая кислоты), · дополнительную NH2-группу (лизин, аргинин, гистидин, также глутамин, аспарагин).
|
|||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 607; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.34.97 (0.008 с.) |