
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация аминокислот по химическому строению радикаловСодержание книги
Поиск на нашем сайте
ФУНКЦИИ БЕЛКОВ Белки можно классифицировать в соответствии с их биологическими функциями; например, белки можно подразделить на структурные, каталитические и транспортные.
Каталитическая функция. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, являются белками. Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Но главную роль играют актин и миозин – специфические белки мышечной ткани. Транспортная функция. Перенос кислорода кровью осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов. Высокая специфичность взаимодействия антител с антигенами (чужеродными вещества) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, который предохраняет от потери крови. Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке. В комплексе с липидами (фосфолипидами) белки участвуют в образовании биомембран клеток. Гормональная функция. В регуляции обмена веществ важное место занимают гормоны. Ряд гормонов представлен белками (гормоны гипофиза, поджелудочной железы). Питательная функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода (белки яйца - овальбумины). Основной белок молока (казеин) также выполняет питательную функцию.
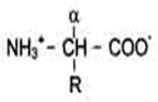
АМИНОКИСЛОТЫ Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка. Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
В водных растворах при нейтральном значении рН α-аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных α-аминокислот, пролин - иминокислота, радикал которой связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому. Аминокислоты
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 августа 2011; проверки требует 1 правка.
ПЕПТИДНАЯ СВЯЗЬ. СТРОЕНИЕ ПЕПТИДОВ. Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы — COOH, так и основные свойства, обусловленные аминогруппой — NH 2. Аминокислоты взаимодействуют с кислотами и щелочами: NH 2 — CH 2 — COOH + HCl → HCl • NH 2 — CH 2 — COOH (хлороводородная соль глицина) NH 2 — CH 2 — COOH + NaOH → H 2 O + NH 2 — CH 2 — COONa (натриевая соль глицина) Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей. NH 2 — CH 2 COOH Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию пептидов. α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т.е. является амидной связью. При этом происходит отщепление молекулы воды.
Строение пептида Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, окгапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют "полипептиды", а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Однако эти названия условны, так как в литературе термин "белок" часто употребляют для обозначения полипептида, содержащего менее 50 аминокислотных остатков. Например, гормон глюкагон, состоящий из 29 аминокислот, называют белковым гормоном. Мономеры аминокислот, входящих в состав белков, называют "аминокислотные остатки". Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную α -карбоксильную группу - С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название "пептидный остов". При названии полипептида к сокращённому названию аминокислотных остатков добавляют суффикс -ил, за исключением С-концевой аминокислоты. Например, тетрапептид Сер-Гли-Про-Ала читается как серилглицилпролилаланин. Пептидная связь, образуемая иминогруппой пролина, отличается от других пептидных связей, так как атом азота пептидной группы связан не с водородом, а с радикалом. Пептиды различаются по аминокислотному составу, количеству и порядку соединения аминокислот. Сер-Гис-Про-Ала и Ала-Про-Гис-Сер - два разных пептида, несмотря на то, что они имеют одинаковые количественный и качественный составы аминокислот.
Образование дипептида
Строение пептидов
ФУНКЦИИ БЕЛКОВ Белки можно классифицировать в соответствии с их биологическими функциями; например, белки можно подразделить на структурные, каталитические и транспортные.
Каталитическая функция. Большинство известных в настоящее время ферментов, называемых биологическими катализаторами, являются белками. Сократительная функция. В акте мышечного сокращения и расслабления участвует множество белковых веществ. Но главную роль играют актин и миозин – специфические белки мышечной ткани. Транспортная функция. Перенос кислорода кровью осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов. Высокая специфичность взаимодействия антител с антигенами (чужеродными вещества) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, который предохраняет от потери крови. Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают по количеству первое место среди других белков тела человека. Среди них важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке. В комплексе с липидами (фосфолипидами) белки участвуют в образовании биомембран клеток. Гормональная функция. В регуляции обмена веществ важное место занимают гормоны. Ряд гормонов представлен белками (гормоны гипофиза, поджелудочной железы). Питательная функция. Эту функцию выполняют так называемые резервные белки, являющиеся источниками питания для плода (белки яйца - овальбумины). Основной белок молока (казеин) также выполняет питательную функцию.
АМИНОКИСЛОТЫ Белки - полимерные молекулы, в которых мономерами служат аминокислоты. В составе белков в организме человека встречают только 20 α-аминокислот. Одни и те же аминокислоты присутствуют в различных по структуре и функциям белках. Индивидуальность белковых молекул определяется порядком чередования аминокислот в белке. Последовательность аминокислот в белке несёт информацию о построении пространственной структуры и функции данного белка. Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
В водных растворах при нейтральном значении рН α-аминокислоты существуют в виде биполярных ионов. В отличие от 19 остальных α-аминокислот, пролин - иминокислота, радикал которой связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В результате эти аминокислоты в природе могут находиться в двух разных изомерных формах - L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
Чистые L- или D-стереоизомеры могут за длительный срок самопроизвольно и неферментативно превращаться в эквимолярную смесь L- и D-изомеров. Этот процесс называют рацемизацией. Рацемизация каждой L-аминокислоты при данной температуре идёт с определённой скоростью. Это обстоятельство можно использовать для установления возраста людей и животных. Так, в твёрдой эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст обследуемого. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому. Классификация аминокислот по химическому строению радикалов По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические. В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амидная (-CO-NH2), гидроксильная (-ОН) и гуанидиновая
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 460; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |







 N + H 3 — CH 2 COO -
N + H 3 — CH 2 COO -


 группы.
группы.


