Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Абсолютная субстратная специфичность
Активный центр ферментов, обладающих абсолютной субстратной специфичностью, комплементарен только одному субстрату. Следует отметить, что таких ферментов в живых организмах мало. Пример фермента с абсолютной субстратной специфичностью - аргиназа, катализирующая реакцию расщепления аргинина до мочевины и орнитина: Другой пример фермента с абсолютной субстратной специфичностью - уреаза, катализирующая гидролиз мочевины до диоксида углерода и аммиака. Групповая субстратная специфичность Большинство ферментов катализирует однотипные реакции с небольшим количеством (группой) структурно похожих субстратов. Так, фермент панкреатическая липаза катализирует гидролиз жиров в двенадцатиперстной кишке человека, катализируя превращение любой молекулы жира (триацилглицерола) до молекулы моноацилглицерола и двух молекул высших жирных кислот. Панкреатическая липаза гидролизует эфирную связь у α-атомов углерода глицерола, независимо от того, какие жирные кислоты входят в состав молекулы жира Большинство протеолитических ферментов, осуществляющих гидролиз белков, имеет групповую субстратную специфичность, гидролизуя пептидные связи, образованные разными аминокислотами. Стереоспецифичность При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам. · Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.
· Стереоспецифичность к L-аминокислотам. Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет Стереоспецифичность к L-аминокислотам. · Стереоспецифичность к цистрансизомерам. Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы.
· Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров. · Стереоспецифичносгь к α- и β -гликозидным связям. Фермент амилаза действует только на а-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
· Этапы ферментативного катализа · 1. Формирование фермент-субстратного · Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура. · В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой ·
· по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение. · 2. Последовательность событий в ходе · Процесс ферментативного катализа условно можно разделить на следующие этапы · Первый, второй и четвёртый этапы катализа непродолжительны и зависят от концентрации субстрата (для первого этапа) и констант связывания лигандов в активном центре фермента (для первого и третьего этапов). Изменения энергетики химической реакции на этих стадиях незначительны. · Третий этап наиболее медленный; длительность его зависит от энергии активации химической реакции. На этой стадии происходят разрыв связей в молекуле субстрата, образование новых связей и формирование молекулы продукта.
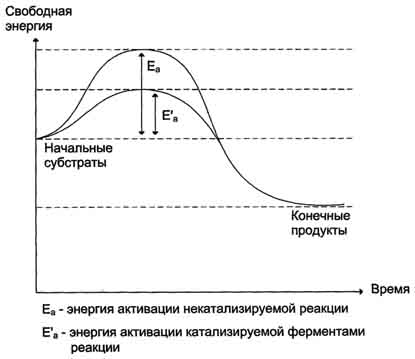
· 3. Роль активного центра в ферментативном · В результате исследований было показано, что молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции. · Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная "машина", использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт. · В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов. · Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата. 23.понятие холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор,активатор.примеры. 1.Простетические группы прочно связаны с белками и даже могут быть присоединены ковалентными связями. Часто играют важную роль в функционировании ферментов. Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент). Примером может являться гем, который является простетической группой в молекуле гемоглобина. 2.Кофактор-небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия). 3.субстрат-вещество, подвергающееся превращению под действием фермента; 4. Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы.Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов. Обратимое ингибирование:
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 634; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.200.197 (0.009 с.) |