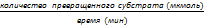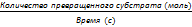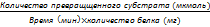Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Каталитическая специфичность⇐ ПредыдущаяСтр 13 из 13
Фермент катализирует превращение присоединённого субстрата по одному из возможных путей его превращения, Это свойство обеспечивается строением каталитического участка активного центра фермента и называется каталитической специфичностью, или специфичностью пути превращения субстрата. Так, молекула глюкозо-6-фосфата в клетках печени человека - субстрат 4 различных ферментов; фос-фоглюкомутазы, глюкозо-6-фосфатфосфатазы, фосфоглюкоизомеразы и глюкозо-6-фосфатдегидрогеназы. Однако из-за особенностей строения каталитических участков этих ферментов происходит различное превращение этого соединения с образованием 4 различных продуктов (см. схему ниже). \
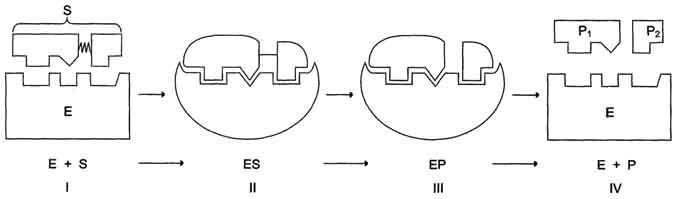
39. механизм действия ферментов 1. Формирование фермент-субстратного Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура. В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение. 2. Последовательность событий в ходе Процесс ферментативного катализа условно можно разделить на следующие этапы (рис. 2-12). Первый, второй и четвёртый этапы катализа непродолжительны и зависят от концентрации субстрата (для первого этапа) и констант связывания лигандов в активном центре фермента (для первого и третьего этапов). Изменения энергетики химической реакции на этих стадиях незначительны.
Третий этап наиболее медленный; длительность его зависит от энергии активации химической реакции. На этой стадии происходят разрыв связей в молекуле субстрата, образование новых связей и формирование молекулы продукта. 3. Роль активного центра в ферментативном В результате исследований было показано, что молекула фермента, как правило, во много раз больше молекулы субстрата, подвергающегося химическому превращению этим ферментом. В контакт с субстратом вступает лишь небольшая часть молекулы фермента, обычно от 5 до 10 аминокислотных остатков, формирующих активный центр фермента. Роль остальных аминокислотных остатков состоит в обеспечении правильной конформации молекулы фермента для оптимального протекания химической реакции. Активный центр на всех этапах ферментативного катализа нельзя рассматривать как пассивный участок для связывания субстрата. Это комплексная молекулярная "машина", использующая разнообразные химические механизмы, способствующие превращению субстрата в продукт. В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов. Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата (рис. 2-12).
Рис. 2-12. Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II - образование фермент-субстратного комплекса (ES) в результате индуцированного соответствия; III - деформация субстрата и образование нестабильного комплекса фермент-продукт (ЕР); IV- распад комплекса (ЕР) с высвобождением продуктов реакции из активного центра фермента и освобождением фермента.
41 изменение активности ферментов при заболеваниях. При нормальных физиологических изменениях организма, например при онтогенезе или адаптации к переменным условиям среды, может изменяться не только каталитическая активность ферментов (в результате действия регуляторных механизмов), но и их количество. Активность ферментов, их количество, а также компартментализация изменяются и при болезнях. Эти проявления болезней называют энзимопатиями; они являются частным случаем протеинопатии.Энзимопатии, как и вообще протеинопатии, бывают наследственные (первичные) и приобретенные (вторичные). Например, врожденное отсутствие фермента гистидазы проявляется как наследственная болезнь гистидинемия. Вследствие нарушения метаболизма гистидина его концентрация в крови и моче больных значительно больше, чем у здоровых людей. Это, в свою очередь, ведет к нарушению обмена и других веществ и, как следствие, к нарушению физического и умственного развития, обычно настолько резкому, что больные не доживают до взрослого состояния. Таким образом, недостаточность даже одного фермента может оказаться несовместимой с жизнью. . Причины, приводящие к увеличению количества Ферменты плазмы крови можно разделить на 2 группы. Первая, относительно небольшая группа ферментов активно секретируется в плазму крови определёнными органами. Например, печень синтезирует неактивные предшественники ферментов свёртывающей системы крови. Ко второй относят большую группу ферментов, высвобождающихся из клеток во время их. нормального функционирования. Обычно эти ферменты выполняют свою функцию внутри клетки и не имеют физиологического значения в плазме крови. У здорового человека активность этих ферментов в плазме низкая и достаточно постоянная, так как постоянно соотношение скоростей высвобождения их из клеток и скоростей разрушения. При многих заболеваниях происходит повреждение клеток, и их содержимое, в том числе и ферменты, высвобождаются в кровь. К причинам, вызывающим высвобождение внутриклеточного содержимого в кровь, относят нарушение проницаемости мембраны клеток (при воспалительных процессах) или нарушение целостности клеток (при некрозе). Определение в крови активности ряда ферментов хорошо налажено в биохимических лабораториях, что используют для диагностики заболеваний сердца, печени, скелетной мускулатуры и других тканей. Уровень активности ферментов в плазме коррелирует со степенью повреждения клеток.
Для энзимодиагностики имеют большое значение знания о субклеточной локализации ферментов. Так, появление в плазме крови ферментов, имеющих только цитозольную локализацию, свидетельствует о воспалительном процессе; при обнаружении митохондриальных или ядерных ферментов можно говорить о более глубоких повреждениях клетки, например о некрозе. Однако повышение концентрации ферментов не всегда связано с повреждением тканей. При избыточной клеточной пролиферации, например при онкопролиферативных процессах, при повышенной скорости синтеза некоторых ферментов в клетках или при нарушенном клиренсе (способности вьпюдиться почками) наблюдают повышение концентрации в крови определённых ферментов. Врачам следует учитывать, что нормальные значения активности ферментов в крови детей и беременных женщин отличаются от показателей, характерных для взрослых здоровых людей. 42. Определение ферментов плазме крови диагностических целях. Происхождение ферментов плазмы крови. Энзимодиагностика – развивается по двум путям. Один путь – использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых). Другой путь – открытие и количественное определение самих ферментов в биологических жидкостях при патологии. Оказалось, что ряд ферментов появляется в сыворотке крови при распаде клеток (отсюда их название «некротические ферменты»). Для диагностики органических и функциональных поражений органов и тканей широко применяются отдельные ферментные тесты, выгодно отличающиеся от других химических диагностических тестов, используемых в клинике, высокой чувствительностью и специфичностью. Известно около 20 тестов, основанных на количественном определении активности ферментов (и изоферментов), главным образом в крови (реже в моче), а также в биоптатах (кусочки тканей, полученные при биопсии). Следует отметить, что из огромного числа ферментов (более 3500), открытых в природе (частично и в организме человека), в диагностической энзимологии используется лишь ограниченный набор ферментов и для весьма небольшого числа болезней (гепатиты, инфаркт миокарда, органические поражения почек, поджелудочной железы, печени и др.). Так, уровень липазы, амилазы, трипсина и химотрипсина в крови резко увеличен при сахарном диабете, злокачественных поражениях поджелудочной железы, болезнях печени и др. Резко повышается в сыворотке крови уровень двух аминотрансфераз, креатинкиназы (и ее изо-форм) и лактатдегидрогеназы (и ее изоформ) при инфаркте миокарда; умеренно повышено их содержание при поражениях тканей мозга и печени. Определяют, кроме того, активность кислой фосфатазы (уровень повышен при карциноме предстательной железы), щелочной фосфатазы, холинэсте-разы и некоторых других органоспецифических ферментов (например, гистидазы, уроканиназы, глицинамидинотрансферазы) в сыворотке крови при патологии костной ткани, печени, метастатических карциномах и т. д. Доказано, что органы и ткани человека характеризуются специфическим ферментным и изоферментным спектром, подверженным не только индивидуальным, но и суточным колебаниям. Существует большой градиент концентрации ферментов между внутриклеточными и внеклеточными частями тела. Поэтому любые, даже незначительные, повреждения клеток (иногда функциональные расстройства) приводят к выделению ферментов во внеклеточное пространство, откуда они поступают в кровь. Механизм гиперферментации (повышенное содержание ферментов в крови) до конца не расшифрован. Повышение уровня внутриклеточных ферментов в плазме крови прямо зависит от природы повреждающего воздействия, времени действия и степени повреждения биомембран клеток и субклеточных структур органов. В оценке ферментных тестов для диагностических целей особое значение имеет знание периода полужизни (полураспада) в плазме крови каждого из диагностических ферментов, что делает важным выбор точного времени для ферментного анализа крови. Весьма существенным является также знание особенностей распределения (топографии) ферментов в индивидуальных органах и тканях, а также их внутриклеточной локализации.
Происхождение ферментов, находящихся в плазме крови, двойственное. Одних ферментов очень много, они выделяются в плазму там выполняют свои функции. Это синтезируемые в печени белки свёртывания крови (тромбин), синтезируемый в гломерулах почек ренин и др. Их называют секреторными ферментами. Концентрации других ферментов очень малы, и они не выполняют своих функций в плазме, поскольку являются органоспецифичными и свои функции выполняют в клетке. Это индикаторные или клеточные ферменты (лактатдегидрогеназа, аминотрансферазы и др.). Когда из-за болезни или травмы поражаются органы или ткани, активность большинства этих ферментов в плазме крови возрастает. Есть также экскреторные ферменты, которые синтезируются в печени (или в других органах) и в физиологических условиях выделяются вместе с желчью (щелочная фосфатаза, γ-глютамилтрансфераза и др.). Когда выделение этих ферментов с желчью нарушается, увеличивается их активность в плазме крови.
В каждом органе есть свойственные ему ферменты. В медицине ферменты используются как показатели патологии или болезни. 43. Применение ферментов в качестве лекарственных средств
Использование ферментов в качестве терапевтических средств имеет много ограничений вследствие их высокой иммуногениости. Тем не менее энзимотерапию активно развивают в следующих направлениях: заместительная терапия - использование ферментов в случае их недостаточности; элементы комплексной терапии - применение ферментов в сочетании с другой терапией.
Заместительная энзимотерапия эффективна при желудочно-кишечных заболеваниях, связанных с недостаточностью секреции пищеварительных соков. Например, пепсин используют при ахилии, гипо- и анацидных гастритах. Дефицит панкреатических ферментов также в значительной степени может быть компенсирован приёмом внутрь препаратов, содержащих основные ферменты поджелудочной железы (фестал, энзистал, мезим-форте и др.).
В качестве дополнительных терапевтических средств ферменты используют при ряде заболеваний. Протеолитические ферменты (трипсин, химотрипсин) применяют при местном воздействии для обработки гнойных ран с целью расщепления белков погибших клеток, для удаления сгустков крови или вязких секретов при воспалительных заболеваниях дыхательных путей. Ферментные препараты рибонуклеазу и дезоксирибонуклеазу используют в качестве противовирусных препаратов при лечении аденовирусных конъюнктивитов, герпетических кератитов.
Ферментные препараты стали широко применять при тромбозах и тромбоэмболиях. С этой целью используют препараты фибринолизина, стрептолиазы, стрептодеказы, урокиназы.
Фермент гиалуронидазу (лидазу), катализирующий расщепление гиалуроновой кислоты, используют подкожно и внутримышечно для рассасывания контрактур рубцов после ожогов и операций (гиалуроновая кислота образует сшивки в соединительной ткани) (см. раздел 8).
Ферментные препараты используют при онкологических заболеваниях. Аспарагиназа, катализирующая реакцию катаболизма аспарагина, нашла применение для лечения лейкозов:
Предпосылкой антилейкемического действия аспарагиназы послужило обнаружение в лейкоз-ных клетках дефектного фермента аспарагинсинтетазы, катализирующего реакцию синтеза аспарагина (см. схему ниже). Лейкозные клетки не могут синтезировать аспарагин и получают его из плазмы крови. Если имеющийся в плазме аспарагин разрушать введением аспарагиназы, то в лейкозных клетках наступит дефицит аспарагина и в результате - нарушение метаболизма клетки. 45. Принципы обнаружения и количественной оценки ферментов. Единицы измерения активности и количества ферментов Ферменты обнаруживают и оценивают по двум критериям: по появлению продуктов реакции или по исчезновению субстратов. Ферменты проявляют специфичность в отношении субстратов и типа реакции. Активность ферментов зависит от температуры, рН среды, концентрации субстрата [S] и концентрации фермента [Е]. Количественная оценка активности ферментов в биологических жидкостях (кровь, моча, слюна) широко используются в клинической практике для диагностики и дифференциальной диагностики заболеваний. Как правило, активность ферментов увеличивается при заболеваниях печени, инфаркте миокарда и других видах патологии. При диагностике болезней, связанных с врожденной недостаточностью метаболизма, определение активности ферментов становится единственным критерием болезни. Количественная оценка активности ферментов основывается на измерении количества образовавшегося продукта реакции или убыли субстрата в единицу времени, отнесенного к 1 мг белка или 1 мл биологической жидкости.
Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени Для выражения концентрации фермента и количественной оценки его активности в условных единицах Комиссией по ферментам Международного биохимического союза была рекомендована стандартная международная единица (МЕ)
Количество единиц активности nME определяют по формуле:
nME=
В 1973 г. была принята новая единица активности ферментов: 1 катал (кат), соответствующий такому количеству катализатора, которое превращает 1 моль субстрата за 1 с. Количество каталов определяют по формуле:
n катал =
Международная единица ферментативной активности ME связана с каталом следующими равенствами:
1 кат = 1 моль S/c = 60 моль S/мин = 60х106 мкмоль/мин = 6х107 ME,
1 ME = 1 мкмоль/мин = 1/60 мкмоль/с = 1/60 мккат = 16,67 нкат.
В медицинской и фармацевтической практике для оценки активности ферментов часто используют международные единицы активности - ME. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность (уд. ак.) фермента, численно равную количеству единиц активности фермента (пМЕ) в образце ткани, делённому на массу (мг) белка в этой ткани:
Уд. ак. =
По удельной активности судят об очистке фермента: чем меньше посторонних белков, тем выше удельная активность. Рекомендовано, кроме того, измерять активность фермента при температуре 25°С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения. В этих случаях скорость соответствует нулевому порядку реакции в отношении субстрата и будет зависеть только от концентрации фермента.
46 Опыты по изучению pH среды, термолабильности и специфичности ферментов техника выполнения Белковая природа обеспечивает ферментам характерные для белков строение и свойства и, прежде всего, лабильность, т.е. способность изменять активность в зависимости от различных факторов (температуры, рН, концентрации фермента и концентрации субстрата, активаторов и ингибиторов и т.п.). Степень изменения активности от различных факторов можно определить по скорости ферментативной реакции. Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. При изучении влияния какого-либо фактора на скорость ферментативной реакции все прочие факторы должны оставаться неизменными и по возможности иметь оптимальные значения.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоком значении к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрат. Кроме того, для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. Специфичность – одно из наиболее выдающихся свойств ферментов. Данное свойство ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. Ферменты могут обладать абсолютной, относительной, стереохимической специфичностью. Влияние на ферменты активаторов и ингибиторов впервые было изучено А.Я.Данилевским. Ингибиторы тормозят действие ферментов. Механизм ингибирующего действия сводится к двум типам торможения (необратимое и обратимое). Обратимое ингибирование действия ферментов может быть конкурентным и неконкурентным. Специфичность действия ферментов – это способность катализировать одну или несколько близких реакций, преобразовывать одно вещество или один вид связей. Специфичность ферментов бывает нескольких видов: абсолютная, относительная (групповая), стереохимическая. Ферменты отличаются от катализаторов небиологической природы высокой специфичностью, что обусловлено индивидуальными особенностями строения активных центров различных ферментов. Пространственная структура активного центра предопределяет не только комплементарность субстрату, но и природу последующих превращений субстрата в фермент- субстратном комплексе, приводящих к образованию соответствующего продукта. Будучи высокоспецифичной, ферментативная реакция протекает в 105-1012 раз быстрее, чем самопроизвольная (спонтанная) реакция.
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ АМИЛАЗЫ И САХАРАЗЫ
Для изучения специфичности этих ферментов используем амилазу слюны и сахаразу хлебопекарных дрожжей. Амилаза слюны (3.2.1.1) по механизму действия является a-амилазой. Катализирует гидролиз a-1,4-гликозидных связей в молекуле крахмала (и гликогена) без определенного порядка. Процесс гидролиза происходит как бы ступенчато и может быть выражен в виде схемы: Крахмал ® Амилодекстрины ® Эритродекстрины ® Ахродекстрины ® Мальтодекстрины ® Мальтоза. Глубину гидролиза крахмала можно контролировать по цветной реакции с раствором йода (см. табл. 8). Сахараза из дрожжей имеет более правильное рабочее название b-фруктофуранозидаза (3.2.1.26). Катализирует гидролиз b-гликозидных связей в молекулах как сахарозы, так и раффинозы, при этом сахароза расщепляется на глюкозу и фруктозу, которые обнаруживаются реакцией Троммера.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ (на активность ферментов)
Скорость ферментативной реакции зависит от температуры. Оптимальным считается то значение ее, при котором реакция протекает с максимальной скоростью. Для большинства ферментов, выделенных из организма теплокровных и многих микроорганизмов оптимальная температура составляет 37-40 °С, для ферментов растительного происхождения – 40-50 ˚С. Повышение температуры сверх оптимальной приводит к уменьшению, а затем прекращению действия фермента, что связанно с денатурацией. При переходе от оптимальной к низким температурам скорость ферментативной реакции падает в 2-2,5 раза на каждые 10 ˚С, достигая минимальной величины при 0 °С и приостанавливается при отрицательных её значениях (минус 18 ˚С). Причиной является снижение скорости движения молекул субстратов и ферментов, что замедляет образование фермент-субстратного комплекса и проведения реакции. При повышении температуры от отрицательных значений действие ферментов восстанавливается, скорость катализируемых реакций возрастает в 2-2,5 раза на каждые 10 ˚С, до оптимальной температуры. Принцип снижения активности ферментов при понижении температуры используется при консервировании сырья и готовой продукции низкими температурами. Инактивация ферментов высокой температурой необратима, используется в пищевой промышленности для консервирования многих продуктов растительного и животного происхождения. ВЛИЯНИЕ рН НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
Ферменты при постоянной температуре работают наиболее эффективно в пределах рН (от 2 до 10). Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью. Отклонение в любую сторону от этого значения сопровождается снижением скорости ферментативной реакции. Это объясняется тем, что ферменты имеют большое число полярных, положительно и отрицательно заряженных групп, участвующих в поддержании нативной конформации, образовании фермент-субстратного комплекса и проведении реакции. Во многих случаях субстраты являются электролитами, и реакция осуществляется лишь с определенными (ионизированными или неионизированными) их формами, возникающими при оптимуме рН. Многие ферменты являются двухкомпонентными (сложными белками), небелковый компонент которых слабо связан с белком ионными, водородными связями в условиях оптимума рН. Сдвиги рН за пределы оптимума вызывают диссоциацию кофактора и разрушение структуры активного центра. Например, пероксидаза диссоциирует в кислой среде на два компонента, однако при рН 7,0 её структура и активность восстанавливаются. При очень низких и очень высоких значениях рН ферменты денатурируют.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1418; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.234.83 (0.051 с.) |