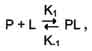Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Разделение индивидуальных белковСтр 1 из 13Следующая ⇒
РАЗДЕЛЕНИЕ ИНДИВИДУАЛЬНЫХ БЕЛКОВ Изучение строения и свойств белков невозможно без их выделения из клетки и очистки от других белков и органических молекул. Стадии: 1. Разрушение клеток изучаемой ткани и получение гомогената. 2. Разделение гомогената на фракции центрифугированием, получение ядерной, митохондриальной, цитозольной или иной фракции, содержащей искомый белок.
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей . Высаливание. Различные белки выпадают в осадок при разной концентрации соли в растворе. Постепенно повышая ее концентрацию, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольшой концентрации солей. 5 Гель-фильтрация — метод молекулярного просеивания молекул через набухшие гранулы сефа-декса (трехмерные полисахаридные цепи декстра-на, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируются с колонки. Ультрацентрифугирование — метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжелые белки образуют фракции, расположенные ближе ко дну кюветы, более легкие — к поверхности. Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных нерастворимых полимеров. Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть возрастающими концентрациями NaCl; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, прикрепленный к ионогенным группам смолы. Аффинная хроматография — наиболее специфический метод выделения индивидуальных белков. К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок.
Электрофорез белков Метод основан на том, что при определённом значении рН и ионной силы раствора бел- ки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки — к катоду (—). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду,в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам. Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, а,-глобулины, а2-глобулины, в-глобулины и у-глобулины Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
3) Хроматография. Принцип основан на способности веществ специфически адсорбироваться на адсорбенте, заключенном в колонке. Ионообменная хроматография метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий.
В качестве неподвижной фазы используют ионообменники — полимерные органические вещества, содержащие заряженные функциональные группы. Различают положительно заряженные анио-нообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу, и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу содержащую анионные группы. Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионооб-менник. При пропускании раствора белка через колонку прочность связывания белка с анионо-обменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионообменнике, можно смыть буферными растворами с различной концентрацией соли, и разными значениями рН. Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли -СМЫВАются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок. Классификация аминокислот Строение пептида Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками.. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную -карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название «пептидный остов» ( Пептиды различаются по аминокислотному составу, количеству и порядку аминокислот. 2. Характеристика пептидной связи Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу Связь между углеродным атомом и аминогруппой или а-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е. -углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, В живых организмах пептидные связи в белках разрываются с помощью специальных про-теолитических ферментов Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию
7. Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Методы изучения первичной структуры белка.
Кислотный гидролиз белка Для определения аминокислотного состава необходимо провести разрушение всех пептидных связей в белке. Анализируемый белок гидролизуют в 6 мол/л НС1 при температуре около 110 °С в течение 24 ч. В результате разрушаются пептидные связи в белке, а в гидролизате присутствуют только свободные аминокислоты Разделение аминокислот с помощью ионообменной хроматографии Смесь аминокислот, полученных кислотным гидролизом белков, разделяют в колонке с катионообменной смолой. Количественный анализ полученных фракций. нагреваютотдельные фракции аминокислот с нингидрином, образующим соединение красно-фиолетового цвета. Интенсивность окраски в пробе пропорциональна количеству находящейся в ней аминокислоты. 2. Определение аминокислотной Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная?-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного?-складчатог 9. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. В стабилизации третичной структуры белка принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Связь с первичной структурой. Третичная структура в значительной степени предопределена первичной структурой. Усилия по предсказанию третичной структуры белка основываясь на первичной структуре известна как задача предсказания структуры белка. Однако, окружающая среда, в которой белок сворачивается существенно определяет конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом включают окружающую среду косвенно. Супервторичная структура белков. сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков.она формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания а-спиралей и б-структур часто обозначают как "структурные мотивы". В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль - в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК 3. Супервторичная структурав виде "цинкового пальца" Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. "Цинковый палец" - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя - гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина 4. Супервторичная структура Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых "лейциновая застёжка-молния". 10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами.Цепи белков соединенные ковалентными связями (например дисульфидными)поэтому инсулин мономерный белок. Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура. Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров.
Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей. В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер. Для белков с четвертичной структурой характерно понятие субъединицы. Субъединица – это функционально активная часть молекулы белка. Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β - цепей. Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия. Активные центры возникают при образовании четвертичной структуры. В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность. Альфа спирали в протомере обозначают латинскими буквами от A до H,начиная с N конца Кооперативные изменения конформациипротомеров.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода.Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой. Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров. Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативнойконформации. Влияние рН на заряд белка При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость. Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
Пример денатурации - свертывание яичных белков при варке яиц. Денатурация бывает обратимой и необратимой. Необратимая денатурация может быть вызвана образованием нерастворимых веществ при действии на белки солей тяжелых металлов — свинца или ртути. РЕНАТУРА́ЦИЯ — процесс восстановления структурной организации биополимера (белковой молекулы или молекул нуклеиновых кислот). Ренатурация возможна только при обратимой денатурации. Ренатурация лежит в основе многих биологических механизмов. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. Ренатурация возможна только если затронута третичная или вторичная структура. При этом восстанавливаются функции данного белка. Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При денатурации белка, вызванной 8М мочевиной или другим агентом, разрушаются в основном нековалентные связи (в частности,гидрофобны взаимодействия и водородные связи). Дисульфидные связи в присутствии восстанавливающего агента меркаптоэтанола разрываются, в то время как пептидные связи самого остова полипептидной цепи не затрагиваются. В этих условиях развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры. Вызывать денатурацию белков могут разнообразные факторы, перечисленные ниже. Нагревание или излучение белка, например инфракрасное или ультрафиолетовое. Кинетическая энергия, сообщаемая белку, вызывает вибрацию его атомов, вследствие чего слабые водородные и ионные связи разрываются,и белок свертывается (коагулирует). Сильные кислоты, щелочи, соли денатурируют белок. Под действием этих реагентов ионные связи разрываются и белок коагулирует. Длительное воздействие реагента может вызвать разрыв и пептидных связей. Тяжелые металлы денатурируют белок. Положительно заряженные ионы тяжелых металлов (катионы) образуют прочные связи с отрицательно заряженными карбоксил-анионами R-групп белка и часто вызывают разрывы ионных связей. Они также снижают электрическую поляризацию белка, уменьшая его растворимость. Вследствие этого находящийся в растворе белок выпадает в осадок. Органические растворители и детергенты денатурируют белок. Эти реагенты нарушают гидрофобные взаимодействия и образуют связи с гидрофобными (неполярными) группами. В результате разрываются и внутримолекулярные водородные связи. Использование спирта в качестве дезинфицирующего средства основано именно на том, что он вызывает денатурацию белка любых присутствующих бактерий.
13.Свойства белковых растворов определяются большими размерами молекул, т.е. белки являются коллоидными частицами и образуют коллоидные растворы. К свойствам белковых растворов относятся: 1. Рассеивание света вследствие дифракции на коллоидных частицах – опалесценция. Особенно это заметно при прохождении луча света через белковый раствор, когда виден светящийся конус (эффект Тиндаля). 2. Белковые растворы в отличие от истинных обладают малой скоростьюдиффузии. 3. Неспособность белковых частиц проникать через мембраны, поры которых меньше диаметра белков (полунепроницаемые мембраны). Это используется в диализе. Очистка белковых препаратов от посторонних примесей лежит в основе работы " искусственной почки " при лечении острой почечной недостаточности. 4. Создание онкотического давления, то есть перемещение воды в сторону более высокой концентрации белка, что проявляется, например, как формирование отеков при повышении проницаемости сосудистой стенки. 5. Высокая вязкость в результате сил сцепления между крупными молекулами, что проявляется, например, при образовании гелей и студней. Главными факторами устойчивости белка в растворе служат заряд молекулы и гидратная оболочка. Реакции осаждения белков Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора. Обратимое осаждение. Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Высаливание. Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Реактивы: 1) неразведенный яичный белок; 2) насыщенный раствор сульфата аммония; 3) NaOH, 10% раствор, 4) CuSO4, 1% раствор; 5) дистиллированная вода; 6) сульфат аммония в порошке. Необратимое осаждение белков. Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. Осаждение при кипячении. Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором - отрицательный заряд, что повышает их устойчивость в растворе. Реактивы: 1) яичный белок, 1% раствор; 2) уксусная кислота, 1% и 10% растворы; 3) NaOH, 10% раствор. 16. Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от bqcx остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд". Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандомвысокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром. А. Активный центр белков и избирательность связывания его с лигандом Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга. Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25). Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом. 1. Характеристика активного центра Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует "рельеф" активного центра. Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют "ансамблем" аминокислот. Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности. Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот. В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например присоединение О2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с О2 определяются свойствами радикалов, окружающих атом железа в составе тема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным. Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Асп85). Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в "ловушке", что облегчает его дальнейшее фосфорилирование. Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов. 2. Многообразие лигандов
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты - в разделе 2). Соединение протомеров в олигомерном белке - пример взаимодействия высокомолекулярныхлигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него. Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
Рис. 1-26. Связывание гексокиназы с глюкозой. 3. Сродство активного центра лиганду Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда. Константа диссоциации - характеристика сродства активного центра лиганду. · Так как взаимодействие белка с лигандом - обратимый процесс, то его можно описать следующим уравнением:
|
|||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 440; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.120.133 (0.101 с.) |