
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основное уравнение кинетической теории газов.Содержание книги
Поиск на нашем сайте
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы газа. Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа очень мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда элементарную площадку Ds (cм. рис.6.1) и вычислим давление, оказываемое на эту площадку. При каждом соударении, молекула, движущаяся перпендикулярно площадке, передает ей импульс т 0 N=n Ds где п – концентрация молекул. Но необходимо учитывать, что реально молекулы движутся к площадке под разными углами и имеют различные скорости. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина из них (1/6) движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку Ds будет: При столкновении с площадкой эти молекулы передадут ей импульс:
Тогда давление газа на стенку сосуда:
Если газ и объеме V содержит N молекул, движущихся со скоростями
характеризующую всю совокупность молекул газа. Уравнение (6.3.1) с учетом (6.3.2) примет вид
Данное выражение называется основным уравнением молекулярно-кинетической теории идеальных газов. Это уравнение как раз и устанавливает связь между давлением и скоростью, вернее среднеквадратичной скоростью. Введем среднюю кинетическую энергию хаотического поступательного движения одной молекулы
или
В данном уравнении давление связано со средней энергией поступательного движения молекул. Давление газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, содержащихся в единице объема. Средняя кинетическая энергия поступательного движения Молекул. Закон Дальтона.
При переходе к равновесию от одной части газа к другой передается энергия. Выравнивается не энергия всего газа как целого, а средняя кинетическая энергия, отнесенная к одной молекуле. Температура газа пропорциональна средней кинетической энергии его молекул: Т ~
где k - постоянная Больцмана, выражающая соотношение между единицей энергии и единицей температуры: k =1,38·10-23 Дж/К. Все молекулы при данной температуре Т имеют одну и ту же среднюю энергию независимо от их сорта. Из формулы (6.4.1) следует, что абсолютная температура является мерой средней кинетической энергии поступательного хаотического движения молекул. При Т=0 замирает тепловое движение, но остаются другие, нетепловые формы движения в веществе, например, движение электронов в атоме. Это движение нельзя прекратить, охлаждая вещество. Выразим теперь uкв через абсолютную температуру Т. Приравнивая правые части в формулах Введем понятие универсальной газовой постоянной R, которая связана с постоянной Больцмана соотношением
Подставляя в основное уравнение кинетической теории газов это выражение, получим, что давление идеального газа связано с температурой соотношением:
Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул. Если имеем смесь нескольких газов, концентрация молекул которых n1, n2,..., ni и
Давления Согласно закону Дальтона в случае идеальных газов
Таким образом, давление, оказываемое на стенки сосуда смесью газов, равно сумме парциальных давлений отдельных компонентов смеси.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 392; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.87.145 (0.007 с.) |


 –(–m 0
–(–m 0 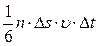 .
. .
.
 ,
,
 .
.

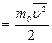 . Тогда основное уравнение запишется как:
. Тогда основное уравнение запишется как:

 ,
,
 .
. , где NA=6·1023моль-1 – число Авогадро (число молекул в одном моле вещества), и молярной массы m= Nam0 –массы одного моля газа. Тогда среднюю квадратичную скорость поступательного движения молекул можно выразить формулой:
, где NA=6·1023моль-1 – число Авогадро (число молекул в одном моле вещества), и молярной массы m= Nam0 –массы одного моля газа. Тогда среднюю квадратичную скорость поступательного движения молекул можно выразить формулой: .
.
 .
.
 , то
, то .
. называют парциальными давлениями. Например, р1 – парциальное давление соответствует давлению, которое оказывал бы первый газ, входящий в состав смеси, если бы он занимал весь объем.
называют парциальными давлениями. Например, р1 – парциальное давление соответствует давлению, которое оказывал бы первый газ, входящий в состав смеси, если бы он занимал весь объем. .
.



