
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартный, или титрованный, раствор (титрант)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Содержание Введение…………………………………………………………………………………..………..2 §1 Сущность объемного анализа………………………………….……….……………………..2 1.1 Определяемое вещество…………………………………………….……………………..2 1.2 Реагент (реактив)……………………………………………………..…..………………..3 1.3 Титрование……………………………………………………………....…………………3 1.4 Стандартный, или титрованный, раствор (титрант)………………….……..….……….4 1.5 Нормальность раствора………………………………………………...………….………4 1.6 Правило эквивалентности…………………………………………………………………4 1.7 Точка эквивалентности и конечная точка титрования………………………...….…….5 1.8 Навеска анализируемого вещества……………………………………………………….6 1.9 Требования, предъявляемые к реакциям…………………………………………..……10 1.10Реагенты, применяемые при титровании………………………………………………10 1.11Условия титрования……………………………………………………………….……..11 §2 Общее уравнение реакции титрования и выводы из него………………………….………12 2.1 Общее уравнение реакции титрования…………………………………………...……..13 2.2 Общие приемы титрования………………………………………………………...…….15 §3 Титрование по методу нейтрализации………………………………………………………16 3.1 Сущность метода………………………………………………..……………….………..16 3.2Классификация метода…………………………………………………….….………….17 3.3 Приготовление рабочих растворов………………………………………………...….…18 3.4 Расчет кривой…………………………………………………………………..….………21 3.5 Построение кривой………………………………………………………..…….………...27 3.6 Подбор индикатора. Расчет ошибок…………………………………….……….………28 Вывод……………………………………………………………………….…………..……...29 §4 Окислительно-восстановительное титрование…………………………………...………...30 4.1 Классификация…………………………………………………………………..………..30 4.2Условия проведения……………………………………………………………...………..30 4.3 Виды окислительно-восстановительного титрования……………………….…..……..31 4.4 Индикаторы…………………………………………………………………….……..…...31 4.5 Йодометрия……………………………………………………………………..…………32 4.5.1 Достоинства и недостатки йодометрии………………………………….…….…...33 4.5.2 Индикаторы йодометрии…………………………………………….…….………..34 4.5.3 Условия титрования…………………………………………………..…..….……...35 4.5.4 Приготовление рабочих растворов………………………………..……..….….…..36 4.6 Расчет кривой……………………………………………………………….…….….……37 4.7 Построение кривой…………………………………………………………….……..…...42 4.8 Подбор индикатора. Расчет ошибок………………………………………………..……43 Вывод……………………………………………………………………………..……………44 Список литературы………………………………………………………………………..……..45 Введение Одним из самых старых и даже в настоящее время распространенных методов химического анализа является титраметрический анализ. Свое применение находят множество видов титраметрического анализа, такие как кислотно-основное, окислительно-восстановительное, осадительное, комплексонометрическое, титрование неводных растворов, физико-инструментальные методы титрования. Используя результаты титрования, можно без труда определить различные вещества. Для проведения анализа нужно знать некоторые понятия и закономерности, в том числе и конечную точку титрования. Для ее определения часто используются индикаторы. Для подбора индикатора необходимо, сделав теоретические расчеты, построить кривую титрования, определить скачок титрования и рассчитать индикаторные ошибки титрования. Поэтому целью данной работы является выбор индикатора и построение кривой титрования. Задачами работы являются расчет точек титрования, выявление области скачка титрования, вычисление точки эквивалентности, вычисление индикаторных ошибок титрования. Сущность объемного анализа Объемным (титриметрическим) методом анализа называют метод количественного анализа, основанный на измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества. Метод заключается в том, что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации. Добавление реактива В продолжают до тех пор, пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества А. Количественные определения с помощью объемного анализа выполняются очень быстро. Время, требуемое для завершения определения объемным методом, измеряется минутами. Это позволяет без особой затраты труда проводить несколько последовательных и параллельных измерений. Основоположником объемного анализа является Ж.Л. Гей-Люссак. Определяемое вещество Химический элемент, простое или сложное вещество, содержание которого определяют в образце анализируемого продукта, называют определяемым веществом и обозначают буквой A. К определяемым веществам относятся также атомы, ионы, связанные и свободные радикалы и функциональные группы. Например, атомы водорода непосредственно связанные с атомами кремния (Si-H),атомы галогенов, входящие в состав ядра или боковой цепи ароматических углеводородов, и т.п.; ионы, входящие в состав растворов кадмиевых, медных, никелевых и цинковых электролитов, ионы алюминия в ваннах для анодирования, ионы магния в растворах для оксидирования магниевых сплавов и т.д. 1.3Реагент (реактив) Твердое, жидкое или газообразное вещество, вступающее в реакцию с определяемым веществом А, называют реагентом и обозначают В. Следует различать понятия «реагент» и «реактив». Реагентом называют вещество, непосредственно вступающее в реакцию, а реактивом- химический препарат, который может представлять собой сложную смесь различных веществ, содержащую наряду с собственно реагентом вспомогательные вещества и растворитель. Например, «реактив Чугаева» (для определения Титрование Количественное определение вещества А объемным (титриметрическим) методом, при котором к раствору исследуемого продукта медленно приливают раствор реагента точно известной концентрации в количестве, соответствующем содержанию определяемого вещества А, называют титрованием. Слово «титрование» происходит от слова «титр». Иногда к титруемому веществу прибавляют реагент в твердом, жидком или газообразном состоянии. Поэтому в широком смысле титрованием называют процесс непрерывно контролируемого постепенного смешивания измеренного количества твердого, жидкого или газообразного вещества, или чаще, точно измерено объема стандартного раствора реагента В с исследуемым веществом. При этом количество реагента соответствует содержанию определяемого компонента А, реагирующего с реагентом В в строго эквивалентных количествах. В так называемых методах безбюреточного титрования не измеряют объем израсходованного на реакцию реактива, поэтому нет необходимости знать точную концентрацию реагента. В этом случае при помощи счетчика подсчитывают число капель израсходованного раствора реагента или измеряют время, пошедшее на титрование данного определяемого вещества. Требования, предъявляемые к реакциям. Реакции, используемые в объемном анализе, должны удовлетворять следующим условиям: 1) вещества, вступающие в реакцию, должна реагировать в строго определенных количественных соотношениях (стехиометрических отношениях); 2) реакции, протекающие между определяемым веществом и стандартным (титрованным) раствором реактива, должны протекать быстро и практически до конца; 3) посторонние вещества, присутствующие в исследуемом продукте и переходящие вместе с основным определяемым компонентом в раствор, не должны мешать титрованию определяемого вещества; 4) точка эквивалентности должна фиксироваться тем или иным способом резко и точно; 5) реакции должны по возможности протекать при комнатной температуре; 6) титрование не должно сопровождаться побочными реакциями, искажающими результаты анализа. Условия титрования В процессе титрования должны строго соблюдаться условия, обеспечивающие достаточную быстроту выполнения анализа и достижение требуемой точности количественного определения (т.е. получение надежных результатов анализа). Ниже указаны наиболее существенные условия титрования: 1. Место титрования должно быть тщательно подготовлено и хорошо освещено дневным или электрическим светом. 2. Применяемые посуда и измерительные приборы должны быть тщательно вымыты и точно откалиброваны перед началом титрования. 3. Используемые реактивы, побочные продукты, вводимые в титруемую смесь, дистиллированная или деионизированная вода должны удовлетворять предъявляемым к ним требованиям и не содержать посторонних примесей, искажающих результаты анализа. 4. В тех случаях, когда на процесс титрования оказывают влияние кислород или двуокись углерода для предотвращения побочных, нежелательных реакций, титрование проводят в атмосфере достаточно инертного газа (обычно в атмосфере газообразного азота) 5. Процесс титрования должен сопровождаться тщательным и непрерывным перемешиванием реагирующих веществ (вручную или при помощи механической или магнитной мешалки). 6. Титрование должно завершаться по возможности в течении 5-10 мин и протекать в строго контролируемых условиях температуры, рН раствора, в присутствии или отсутствие индикатора и т.п. Если необходимо, титрование проводят при нагревании или охлаждении. 7. При титровании следует, согласно методике определения, поддерживать требуемую кислую или щелочную реакцию среды, добавлять в титруемую смесь необходимые электролиты (фон), органические красители или экстрагенты, буферные смеси, комплексообразователи, катализаторы, индукторы, индикаторы и т.п. 8. Выбранный индикаторы или какой-либо инструментальный метод определения конечной точки должны обеспечивать наиболее четкую и резкую фиксацию этой точки титрования, по возможности совпадающей с точкой эквивалентности. 9. Титры применяемых стандартных растворов перед титрованием должны быть тщательно установлены или проверены по химически чистым установочным веществам. 10. Все параллельные титриметрические определения определения необходимые закончить в один рабочий день. Перенесение параллельных титрований на следующий день возможно лишь в случае полной уверенности в устойчивости титра стандартного раствора, применяемого для титрования. Если такой уверенности нет, следует на другой день снова проверить титр титранта. Общие приемы титрования. Прямое титрование. Простейший прием титрования в объемном анализе состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, по каплям приливают из точно калиброванной бюретки стандартный (титрованный) раствор реагента В. Точку эквивалентности устанавливают по резкому уменьшению Если в распоряжении аналитика имеется титрованный раствор требуемого реагента В, то весь процесс прямого титрования вещества А занимает несколько минут. Зная количество стандартного раствора реагента В, израсходованного на реакцию с определяемым веществом А, можно легко вычислить содержание вещества А. Примером применения прямого метода титрования является определение содержания HCL в технической соляной кислоте с помощью NaOH. Обратное титрование Иногда по тем или иным причинам нельзя применить метод прямого титрования. Тогда прибегают к так называемому методу обратного титрования (титрование по остатку). Этот прием состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, приливают точно измеренный объем титрованного раствора реагента В, взятый в избытке. Избыток не вошедшего в реакцию реагента В оттитровывают стандартным раствором другого вспомогательного реагента Например, для определения содержания HCL в соляной кислоте неизвестной концентрации можно прибавить к ней точно отмеренное количество титрованного раствора Сущность метода В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами: Н+ + ОН- = Н2О, Н3О+ + ОН- = 2Н2О При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.). В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НСl, Н2SО4) и сильных оснований (КОН, NaOH). В зависимости от природы титранта кислотно-основное титрование включает два основных метода: ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот, Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром (см.3.3). В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту. Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований. Классификация метода В кислотно-основном методе титрования различают три случая титрования: 1. Титрование сильной кислоты сильной щелочью и наоборот: НСl + NaOH = NaCl + H2O; H+ + OH- = H2O Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу. 2. Титрование слабой кислоты сильной щелочью: СН3СООН + NaOH = CH 3COONa + H2O В ионном виде: СН3COOH + OH- = CH3COO- + H2O В точке эквивалентности образуется соль слабой кислотой и сильного основания, которая вступает в реакцию гидролиза: СH3COONa + HOH ↔ CH3COOH + NaOH В ионном виде: СН3СОО- + НОН ↔ СН3СООН + ОН- В растворе накапливаются ионы ОН- и точка эквивалентности будет находиться в щелочной среде (рН > 7), не совпадая с точкой нейтральности. 3. Титрование слабого основания сильной кислотой: NH4OH + HCl = NH4Cl + H2O В ионном виде: NH4OH + H+ = NH4+ + H2O Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности. Вывод С помощью расчетов точек кривой титрования по методу «нейтрализации» кривой 0,2 н Na2CO3 - 0,1 M HBr, вычислили скачок титрования. Скачок небольшой, это обуславливается тем, что слабая кислота титруется сильным основанием. С помощью расчета индикаторных ошибок, подобрали оптимальные индикаторы. С индикатором _________________ индикаторная ошибка составила _____________ С индикатором ___________ ошибка составила _____________. Ошибка со вторым индикатором меньше, следовательно, титровать раствор Na2CO3 раствором HBr лучше со вторым индикатором.
Индикаторы метода В титрометрическом методе определяют КТТ индикаторным методом. При этом индикатор может играть роль либо реагента, участвующего в окислительно-восстановительной реакции, либо являться специальным вводимым индикатором. В соответствии с этим индикаторы в окислительно-восстановительном титровании можно классифицировать следующим образом: · Индикатор-реагент - участвует в окислительно-восстановительной реакции (пермангонатометрия); · Индикатор - вступает в непосредственное взаимодействие с окислителем или восстановителем (участвующими в окислительно-восстановительной реакции) с образованием различных соединений (крахмал). · Индикатор - при определенном потенциале раствора окисляется или восстанавливается с изменением окраски (окислительно-восстановительные индикаторы). Окислительно-восстановительные индикаторы бывают обратимыми и необратимыми. Обратимые индикаторы меняют окраску обратимо при потенциале раствора в точке эквивалентности или вблизи ее и при этом не разрушаются. Необратимые индикаторы изменяют окраску при достижении определенного значения потенциала в точке эквивалентности или вблизи ее и при этом необратимо разрушаются. Пример – метиловый оранжевый, метиловый красный, нейтральный красный. Йодометрия Йодометрия - метод окислительно-восстановительного титрования, основанный на реакциях, связанных с окислением восстановителей свободным йодом I2 или с восстановлением окислителей йодидом калия KI. Оба процесса можно выразить следующей схемой: I2 + 2е → 2I- Т.к. стандартный окислительно-восстановительный потенциал пары невелик φ0(I2/2I-) = 0,54 В, йод является относительно слабым окислителем, а ионы I- – сравнительно сильным восстановителем. С помощью метода йодометрии можно определять: 1. Восстановители SO32-, S2O32-, NO2-, S2-, CN-, SCN- и др.: а) путем прямого титрования анализируемого раствора раствором йода: SO32- + I2 + 2Н2О = SO42- + 2I- + 2H+ б) путем обратного титрования. Используется, если скорость взаимодействия восстановителя с йодом невелика. В этом случае к раствору восстановителя добавляют избыток титрованного раствора I2, а спустя некоторое время не вступивший в реакцию йод титруют раствором тиосульфата натрия: 2S2O32- + I2 = S4O62- + 2I- 2. Окислители Fe3+, Cr2O72-, H2O2, Cl2, Br2, ClO3-, MnO4- и др. Проводить определение, титруя раствор окислителя йодидом калия KI нельзя, т.к. невозможно фиксировать конец титрования. Поэтому пользуются методом замещения: к анализируемому раствору окислителя добавляют избыток раствора KI: 2MnO4- + 10I- + 16H+ = 5I2 + 2Mn2+ + 8Н2О В результате реакции выделяется йод в количестве, эквивалентном количеству окислителя; йод титруют раствором тиосульфата натрия по уравнению: 2S2O32- + I2 = S4O62- + 2I- Индикаторы йодометрии Фиксируют конечную точку титрования в методе йодометрии с помощью специфического индикатора – крахмала, который образует с йодом комплексно-адсорбционное соединение синего цвета. Эта реакция очень чувствительна, она позволяет легко обнаруживать йод при концентрации 10-5 н. Т.к. соединение йода с крахмалом очень прочное, крахмал следует добавлять в конце титрования, когда окраска раствора становится бледно-желтой. Если вводить крахмал раньше, то очень много йода будет связано с крахмалом. При титровании йод с трудом освобождается из соединения с крахмалом, и результат титрования окажется неточным. Условия титрования При проведении йодометрических определений следует соблюдать следующие условия: 1. Т.к. стандартный окислительно-восстановительный потенциал пары I2/2I- невелик, многие йодометрические определения не доходят до конца. Поэтому для количественного протекания реакций необходимо создавать специальные условия (вводить комплексообразователи, осадители, буферные добавки и т.д.). 2. Йод – вещество летучее, поэтому титрование проводят на холоду. Кроме того, при увеличении температуры снижается чувствительность крахмала как индикатора (при 500 С индикатор в 10 раз менее чувствителен, чем при 250 С). 3. Растворимость йода в воде мала, поэтому определение окислителей необходимо проводить в присутствии большого избытка KI, который образует с йодом растворимое нестойкое комплексное соединение: KI + I2 → K[I3] 4. Скорость реакции между окислителями и KI обычно невелика, поэтому к титрованию выделившегося йода обычно приступают спустя некоторое время. 5. Йодометрическое титрование нельзя проводить в щелочной среде, т.к. протекает побочная реакция: I2 + 2OH- = IO- + I- + Н2О Образующийся гипойодит является более сильным окислителем, чем йод, он окисляет тиосульфат до сульфата: S2O32- + 4IO- + 2OH- = 4I- + 2SO42- + Н2О. Поэтому во избежание побочных реакций титрование проводят при рН не более 9. 6. В кислых растворах йодиды постепенно окисляются кислородом воздуха: 4I- + O2 + 4H+ = 2I2 + 2Н2О Свет ускоряет эту реакцию, поэтому реакционную смесь хранят в темноте. Построение кривой
Вывод С помощью расчетов точек кривой титрования по методу ОВТ кривой 0.1 н HAsO2 - 0.15 M KIO3, вычислили скачок титрования, равный. Так как скачок небольшой, построили кривую титрования. С помощью расчета индикаторных ошибок, подобрали оптимальные индикаторы. С индикатором ___________________________ индикаторная ошибка составила меньшее значение. Со ________ индикатором ошибка составила ____________ Следовательно, титровать раствор раствором HAsO2 KIO3 можно со ___________ индикатором.
Список литературы 1. Васильев В.П. «Аналитическая химия» в двух книгах: Кн.1: «Титриметрические и гравиметрические методы анализа» Учеб. Для студ. ВУЗов, обучающихся по химико-технологических спец. – 3-е издание, стереотип. – Москва: Дрофа, 2003год – 368с. 2. Гильманшина С. И. «Основы аналитической химии: курс лекций» Доп. УМО по направлениям пед образования РФ в качестве учебного пособия для ВУЗов\С.И.- изд. СПб, Питер 2006год-224с. (Учебное пособие) 3. Крешков А.П. «Основы аналитической химии. Теоретические основы. Количественный анализ» том №1. Издательство №3(перераб.). Учебное пособие для студентов химико-технологических спец. ВУЗов. Москва, химия,1970год.471с. 4. Лурье Ю.Ю. «Справочник по аналитической химии» 5-е издание, переработ. И доп. - Москва:химия,1979год-480с 5. Харитонов Ю.Я. «Аналитическая химия» кн.1 «Общие теоретические основы» Количественный анализ: Учеб. - Москва: Высшая школа. 2001год – 615с.
Содержание Введение…………………………………………………………………………………..………..2 §1 Сущность объемного анализа………………………………….……….……………………..2 1.1 Определяемое вещество…………………………………………….……………………..2 1.2 Реагент (реактив)……………………………………………………..…..………………..3 1.3 Титрование……………………………………………………………....…………………3 1.4 Стандартный, или титрованный, раствор (титрант)………………….……..….……….4 1.5 Нормальность раствора………………………………………………...………….………4 1.6 Правило эквивалентности…………………………………………………………………4 1.7 Точка эквивалентности и конечная точка титрования………………………...….…….5 1.8 Навеска анализируемого вещества……………………………………………………….6 1.9 Требования, предъявляемые к реакциям…………………………………………..……10 1.10Реагенты, применяемые при титровании………………………………………………10 1.11Условия титрования……………………………………………………………….……..11 §2 Общее уравнение реакции титрования и выводы из него………………………….………12 2.1 Общее уравнение реакции титрования…………………………………………...……..13 2.2 Общие приемы титрования………………………………………………………...…….15 §3 Титрование по методу нейтрализации………………………………………………………16 3.1 Сущность метода………………………………………………..……………….………..16 3.2Классификация метода…………………………………………………….….………….17 3.3 Приготовление рабочих растворов………………………………………………...….…18 3.4 Расчет кривой…………………………………………………………………..….………21 3.5 Построение кривой………………………………………………………..…….………...27 3.6 Подбор индикатора. Расчет ошибок…………………………………….……….………28 Вывод……………………………………………………………………….…………..……...29 §4 Окислительно-восстановительное титрование…………………………………...………...30 4.1 Классификация…………………………………………………………………..………..30 4.2Условия проведения……………………………………………………………...………..30 4.3 Виды окислительно-восстановительного титрования……………………….…..……..31 4.4 Индикаторы…………………………………………………………………….……..…...31 4.5 Йодометрия……………………………………………………………………..…………32 4.5.1 Достоинства и недостатки йодометрии………………………………….…….…...33 4.5.2 Индикаторы йодометрии…………………………………………….…….………..34 4.5.3 Условия титрования…………………………………………………..…..….……...35 4.5.4 Приготовление рабочих растворов………………………………..……..….….…..36 4.6 Расчет кривой……………………………………………………………….…….….……37 4.7 Построение кривой…………………………………………………………….……..…...42 4.8 Подбор индикатора. Расчет ошибок………………………………………………..……43 Вывод……………………………………………………………………………..……………44 Список литературы………………………………………………………………………..……..45 Введение Одним из самых старых и даже в настоящее время распространенных методов химического анализа является титраметрический анализ. Свое применение находят множество видов титраметрического анализа, такие как кислотно-основное, окислительно-восстановительное, осадительное, комплексонометрическое, титрование неводных растворов, физико-инструментальные методы титрования. Используя результаты титрования, можно без труда определить различные вещества. Для проведения анализа нужно знать некоторые понятия и закономерности, в том числе и конечную точку титрования. Для ее определения часто используются индикаторы. Для подбора индикатора необходимо, сделав теоретические расчеты, построить кривую титрования, определить скачок титрования и рассчитать индикаторные ошибки титрования. Поэтому целью данной работы является выбор индикатора и построение кривой титрования. Задачами работы являются расчет точек титрования, выявление области скачка титрования, вычисление точки эквивалентности, вычисление индикаторных ошибок титрования. Сущность объемного анализа Объемным (титриметрическим) методом анализа называют метод количественного анализа, основанный на измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества. Метод заключается в том, что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации. Добавление реактива В продолжают до тех пор, пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества А. Количественные определения с помощью объемного анализа выполняются очень быстро. Время, требуемое для завершения определения объемным методом, измеряется минутами. Это позволяет без особой затраты труда проводить несколько последовательных и параллельных измерений. Основоположником объемного анализа является Ж.Л. Гей-Люссак. Определяемое вещество Химический элемент, простое или сложное вещество, содержание которого определяют в образце анализируемого продукта, называют определяемым веществом и обозначают буквой A. К определяемым веществам относятся также атомы, ионы, связанные и свободные радикалы и функциональные группы. Например, атомы водорода непосредственно связанные с атомами кремния (Si-H),атомы галогенов, входящие в состав ядра или боковой цепи ароматических углеводородов, и т.п.; ионы, входящие в состав растворов кадмиевых, медных, никелевых и цинковых электролитов, ионы алюминия в ваннах для анодирования, ионы магния в растворах для оксидирования магниевых сплавов и т.д. 1.3Реагент (реактив) Твердое, жидкое или газообразное вещество, вступающее в реакцию с определяемым веществом А, называют реагентом и обозначают В. Следует различать понятия «реагент» и «реактив». Реагентом называют вещество, непосредственно вступающее в реакцию, а реактивом- химический препарат, который может представлять собой сложную смесь различных веществ, содержащую наряду с собственно реагентом вспомогательные вещества и растворитель. Например, «реактив Чугаева» (для определения Титрование Количественное определение вещества А объемным (титриметрическим) методом, при котором к раствору исследуемого продукта медленно приливают раствор реагента точно известной концентрации в количестве, соответствующем содержанию определяемого вещества А, называют титрованием. Слово «титрование» происходит от слова «титр». Иногда к титруемому веществу прибавляют реагент в твердом, жидком или газообразном состоянии. Поэтому в широком смысле титрованием называют процесс непрерывно контролируемого постепенного смешивания измеренного количества твердого, жидкого или газообразного вещества, или чаще, точно измерено объема стандартного раствора реагента В с исследуемым веществом. При этом количество реагента соответствует содержанию определяемого компонента А, реагирующего с реагентом В в строго эквивалентных количествах. В так называемых методах безбюреточного титрования не измеряют объем израсходованного на реакцию реактива, поэтому нет необходимости знать точную концентрацию реагента. В этом случае при помощи счетчика подсчитывают число капель израсходованного раствора реагента или измеряют время, пошедшее на титрование данного определяемого вещества. Стандартный, или титрованный, раствор (титрант) Раствор реагента В точно известной концентрации, применяемый для титрования в методах объемного (титриметрического) анализа, называют стандартным,или титрованным, раствором, или титрантом. 1.6 Нормальность раствора Нормальность раствора выражают числом грамм-эквивалентов вещества, содержащегося в 1 л раствора:
Титр ( Точную концентрацию стандартного раствора реагента В (титранта) называют тиром и выражают числом граммов растворенного вещества, содержащегося в 1
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 2187; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.225.134 (0.018 с.) |

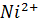 ) представляет собой смесь диметилглиоксима со спиртом и водным раствором аммиака (собственно реагентом в этом реактиве является диметилглиоксим); «реактив Несслера» (для определения
) представляет собой смесь диметилглиоксима со спиртом и водным раствором аммиака (собственно реагентом в этом реактиве является диметилглиоксим); «реактив Несслера» (для определения  )- смесь
)- смесь  , реагентом в этом реактиве служит
, реагентом в этом реактиве служит  ; «реактив Швейцера» - смесь:
; «реактив Швейцера» - смесь:  , соответствующий реагент [
, соответствующий реагент [  . Поэтому термины «реатив» и «реагент» не всегда можно считать синонимами.
. Поэтому термины «реатив» и «реагент» не всегда можно считать синонимами. , сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения
, сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения  (по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.
(по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.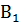 точно известной концентрации. На титрование избытка реагента В должно идти не менее 15-20 мл реагента
точно известной концентрации. На титрование избытка реагента В должно идти не менее 15-20 мл реагента  (макрометодом) или 1,5-2 мл (микрометодом).
(макрометодом) или 1,5-2 мл (микрометодом).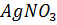 , взятого с избытком, а затем непрореагировавший избыток оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого AgSCN.
, взятого с избытком, а затем непрореагировавший избыток оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого AgSCN.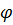
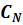 (или N)
(или N)

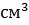 (мл) раствора.
(мл) раствора.


