
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общее уравнение реакции титрования и выводы из него ⇐ ПредыдущаяСтр 3 из 3
Методы установления точек эквивалентности. Установление (фиксирование) конечной точки титрования или точки эквивалентности представляет собой важнейшую операцию титриметрического метода анализа, так как от точности определения точки эквивалентности зависит точность результатов анализа. Обычно конец титрования устанавливают по изменению окраски титруемого раствора или индикатора, вводимого в начале или процессе титрования. Применяют также безындикаторные методы, основанные на использовании специальных приборов, позволяющих судить об изменениях, которые происходят в титруемом растворе в процессе титрования. Такие методы называют физико-химическими, или инструментальными, методами определения точек эквивалентности. Они основаны на изменении электропроводности, величин потенциалов, оптической плотности и других физико-химических параметров титруемых растворов, которые резко изменяются в точке эквивалентности. Общие приемы титрования. Прямое титрование. Простейший прием титрования в объемном анализе состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, по каплям приливают из точно калиброванной бюретки стандартный (титрованный) раствор реагента В. Точку эквивалентности устанавливают по резкому уменьшению Если в распоряжении аналитика имеется титрованный раствор требуемого реагента В, то весь процесс прямого титрования вещества А занимает несколько минут. Зная количество стандартного раствора реагента В, израсходованного на реакцию с определяемым веществом А, можно легко вычислить содержание вещества А. Примером применения прямого метода титрования является определение содержания HCL в технической соляной кислоте с помощью NaOH. Обратное титрование Иногда по тем или иным причинам нельзя применить метод прямого титрования. Тогда прибегают к так называемому методу обратного титрования (титрование по остатку). Этот прием состоит в том, что к определенному объему раствора или к определенной навеске вещества А, растворенного в подходящем растворителе, приливают точно измеренный объем титрованного раствора реагента В, взятый в избытке. Избыток не вошедшего в реакцию реагента В оттитровывают стандартным раствором другого вспомогательного реагента
Например, для определения содержания HCL в соляной кислоте неизвестной концентрации можно прибавить к ней точно отмеренное количество титрованного раствора
|
|||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 288; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.203.68 (0.005 с.) |
 , сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения
, сопровождающемуся, например, исчезновением окраски раствора (если определяемое вещество А окрашено) или по началу повышения  (по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.
(по появлению окраски раствора, если реагент В окрашен), или по изменению окраски индикатора.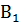 точно известной концентрации. На титрование избытка реагента В должно идти не менее 15-20 мл реагента
точно известной концентрации. На титрование избытка реагента В должно идти не менее 15-20 мл реагента  (макрометодом) или 1,5-2 мл (микрометодом).
(макрометодом) или 1,5-2 мл (микрометодом).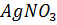 , взятого с избытком, а затем непрореагировавший избыток оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого AgSCN.
, взятого с избытком, а затем непрореагировавший избыток оттитровать стандартным раствором подходящего реагента, реагирующего с ионами серебра, не вошедшими в реакцию. Таким реагентом является роданид аммония, вступающий в реакцию с ионами серебра с образованием малорастворимого AgSCN.


