
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамический метод изучения тепловых явленийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В основе термодинамического метода лежат следующие понятия: термодинамическая система, состояние термодинамической системы, термодинамические параметры состояния и равновесное состояние. Термодинамической системой называют тело или совокупность тел, обменивающихся энергией между собой и с внешними телами. Если обмена энергией с внешними телами нет, то система является изолированной. Понятие изолированной системы – абстракция, все реальные системы можно считать изолированными с той или иной степенью точности. С понятием состояния учащиеся уже знакомы из курса механики. Они знают, что механическое состояние системы определяется совокупностью величин, характеризующих свойства системы и называемых параметрами состояния. К ним в механике относят координату, импульс и т.д. Состояние термодинамической системы также определяется рядом параметров (термодинамических). Термодинамическими параметрами состояния являются температура, объём, давление и т.д. Число параметров, характеризующих состояние системы, зависит от свойств системы и от условий, в которых она находится. Трёх выше названных параметров достаточно для описания изолированной системы «идеальный газ», но если рассматривать, например, неоднородный газ, то необходимо учитывать ещё и концентрацию. Параметры могут быть внешними и внутренними, Температура и давление, например, зависят только от состояния самой системы и не связаны с внешними условиями. Объём же зависит от внешних условий. Некоторые параметры состояния, например объём, обладают свойством аддитивности, другие, такие, как давление и температура, не обладают. При изменении состояния системы меняются и её параметры. Однако для целого ряда термодинамических систем между параметрами можно установить функциональную зависимость. Уравнение, выражающее эту зависимость, называют уравнением состояния (для системы «идеальный газ» это уравнение Состояние системы может быть равновесным и неравновесным. Равновесное состояние характеризуется неизменностью всех термодинамических параметров системы во времени и одинаковостью в пространстве в отсутствие внешних воздействий. Термодинамика изучает в основном равновесные состояния. Если система находится в неравновесном состоянии (т.е. параметры ее с течением времени меняются), то постепенно она придёт в состояние равновесия и её параметры выровняются во всех частях системы. Изолированная термодинамическая система с течением времени всегда приходит в равновесное состояние, из которого не может самопроизвольно выйти. Это утверждение составляет сущность закона термодинамического равновесия, являющегося одним из важнейших опытных законов термодинамики. Иногда закон термодинамического равновесия делает возможным измерение температуры системы. Целесообразно подчеркнуть, что уравнение состояния идеального газа и частные газовые законы справедливы лишь для равновесных процессов. К неравновесным процессам они неприменимы, так как в этом случае параметры состояния различны для разных частей системы. Из одного равновесного состояния в другое система может перейти под влияние внешнего воздействия. Такой переход в термодинамике называют процессом. Если во время процесса система остаётся равновесной, то и процесс называется равновесным. Равновесный процесс осуществляется тогда, когда время релаксации (время перехода системы из неравновесного состояния в равновесное) много меньше времени осуществления процесса. В этом случае систему в каждый момент времени с той или иной степенью точности считают равновесной, или статической. Поскольку в действительности отклонения от статичности имеются (иначе нельзя было бы осуществить процесс), то состояние системы называют квазистатическим, а процесс – квазистатическим процессом. Следует иметь ввиду, что на графике можно изобразить только равновесное (квазистатическое) состояние или равновесный (квазистатический) процесс.
|
||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 536; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.201 (0.006 с.) |

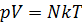 ).
).


