
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутренняя энергия. Количество теплоты.Содержание книги
Поиск на нашем сайте Существуют различные формы энергии. Каждая форма присуща определённому типу движения материи, например, механическому движению соответствует механическая энергия, движению электрических зарядов – энергия электрического и магнитного полей и т.д. С тепловым движением связана внутренняя энергия. Понятие «внутренняя энергия» возникло развилось в науке в 19 в. в связи установлением закона сохранения энергии и благодаря успехам, достигнутым в области молекулярно-кинетической теории. Этот термин не сразу получил правильную трактовку. Во второй половине 19 в. для обозначения внутренней энергии использовали термины: «механическая энергия тела в данном состоянии», «функция действия», «энергия тела» и др. В слове «теплота» очень долго объединялись три понятия: 1) получаемое или отдаваемое телом количество теплоты; 2) внутренняя энергия; 3) тепловое движение. Такое смешение методически не является правомерным, так как в этом случае первый закон термодинамики превращается в бессмыслицу. Именно введение понятия внутренней энергии позволило распространить закон сохранения энергии на тепловые процессы: при наличии диссипативных сил убыль механической энергии системы равна увеличению её внутренней энергии. Под внутренней энергией тела в термодинамике понимают энергию, зависящую только от го внутреннего состояния и не связанную с движением относительно других тел. Внутренняя энергия является однозначной функцией состояния тела, которое определяется рядом параметров (давление, объём, температура). Это означает, что в каждом состоянии (или система) обладает лишь одним значением внутренней энергии. Это положение можно доказать на примере следующего рассуждения: если бы одному и тому же состоянию соответствовали два значения внутренней энергии Следовательно, изменение внутренней энергии системы при переходе из одного состояния в другое не зависит от этого перехода, т.е. внутренняя энергия является функцией состояния системы, а не функцией процесса. Термодинамическая трактовка понятия внутренней энергии не полностью раскрывает его смысл. Для более полного определения этого понятия необходимо рассмотреть его молекулярно-кинетическую трактовку. В современной физике под внутренней энергией понимают сумму энергий хаотического движения и взаимодействия молекул и энергии движения и взаимосвязи частиц, составляющих молекулы (энергия колебательного движения частиц, энергия электронных оболочек атомов, внутриядерная энергия и т.д.). Поскольку в термодинамике изучают тепловые процесс, происходящие при не слишком высоких температурах, изменение внутренней энергии происходит лишь за счёт изменения двух первых её составляющих. Поэтому при рассмотрении тепловых явлений под внутренней энергией можно понимать сумму кинетической энергии хаотического движения молекул и потенциальной энергии их взаимодействия:
Как правило, нас интересует не само значение внутренней энергии, а её изменение, поэтому начало отсчёта внутренней энергии выбирают произвольно. Внутренняя энергия может изменяться под действием каких-либо внешних факторов, либо при совершении работы, либо в процессе теплопередачи. В первом случае мерой изменения внутренней энергии является работа, во втором количество переданного теплоты. Работа, так же как и количество теплоты, зависит не только от конечного и начального состояния системы, но и от того, при каком процессе происходило изменение состояния. Количество теплоты и работа характеризуют процесс изменения состояния и не являются функциями состояния. Следует разъяснить школьникам, что работа и теплопередача – неравноценные способы изменения внутренней энергии. Работа – изменение энергии упорядоченного движения, совершение работы может привести к изменению как механической, так и внутренней энергии. При теплопередаче изменяется энергия хаотического движения частиц системы, а это ведёт лишь к изменению её внутренней энергии. Впервые с понятием внутренней энергии учащихся знакомят в базовом курсе. В старших классах понятие внутренней энергии получает дальнейшее развитие и обобщение на основе молекулярно-кинетических представлений. В частности, внутреннюю энергии. Рассматривают как величину, зависящую от состояния тела (или системы), определяемого термодинамическими параметрами (p,V,T).Подчеркивают мысль: внутренняя энергия является однозначной функцией состояния. Развитие и усугубление понятия внутренней энергии идёт по пути его применения к идеальному газу. Если в рамках термодинамики нас интересует изменение внутренней энергии, то для идеального газа можно вычислить значение внутренней энергии в данном состоянии:
Внутренняя энергия идеального газа зависит только от его температуры. Используя первый закон термодинамики, показывают, как изменяется внутренняя энергия идеального газа при различных изопроцессах, и объясняют характер этого изменения с молекулярно-кинетической точки зрения Понятие количества теплоты и калориметрические расчёты достаточно полно изучают в базовом курсе физики, поэтому в старших классах, этот материал лишь повторяют. Первый закон термодинамики Изучение первого закона термодинамики продолжает формировать представления старшеклассников о фундаментальном естественнонаучном принципе – принципе сохранения энергии. Открытие первого закона термодинамики относится к числу трех крупнейших события 19 в., наряду с открытием клетки и созданием теории Дарвина. В школьном курсе физики первый закон термодинамики изучают как обобщение большого числа опытных данных, установивших соотношение между количеством теплоты, получаемых за счёт работы, и совершённой работой. Прежде чем приступить к изучению первого закона термодинамики, целесообразно повторить закон сохранения энергии в механических процессах, при этом особое внимание уделяют обсуждению вопроса о том, что механическая энергия сохраняется в замкнутых консервативных системах. Если система не является консервативной, то её механическая энергия не сохраняется, она частично или полностью превращается во внутреннюю энергию, но при этом сохраняется полная энергия системы. Далее рассматривают, какими способами можно изменить внутреннюю энергию системы. Этот материал изучали в базовом курсе физики, поэтому здесь его повторяют и обобщают. В результате школьников подводят к выводу: внутреннюю энергию можно изменить либо в процессе теплопередачи, либо при совершении работы, либо про совершении работы и при теплопередаче одновременно. Обсуждают вопрос о мерах измерения внутренней энергии при том или ином процессе. Учащиеся делают вывод: мерой изменения внутренней энергии в процессе совершения работы является работа, а мерой изменения внутренней энергии в процессе теплопередачи – количество теплоты. Здесь же целесообразно повторить вопрос о знаках этих величин. Условились считать количество теплоты положительным ( Работу Рассмотрев ряд примеров, делают вывод: изменение внутренней энергии системы равно сумме количества теплоты, переданного системе, и работе внешних сил над системой:
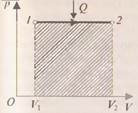
Количество теплоты, сообщённое системе, идёт на увеличение её внутренней энергии и на совершение системой работы над внешними телами. Анализируя формулу первого закона термодинамики, целесообразно ещё раз подчеркнуть, что внутренняя энергия характеризует состояние системы независимо от способа изменения этого состояния, так как внутренняя энергия системы однозначно определяется параметрами: объёмом После изучения первого закона термодинамики целесообразно разобрать со школьникам ряд упражнений на применение его к конкретным процессам. Например, описать энергетически: 1) Теплообмен между телами в калориметре; 2) нагревание воды на спиртовке; 3) нагревание при ударе. В первом случае система замкнутая и теплоизолированная ( Далее целесообразно рассмотреть примеры применения первого закона термодинамики к изопроцессам в идеальных газах. При изобарном нагревании (рис 1) количество теплоты, переданное системе, идёт на увеличение её внутренней энергии и на совершение системой работы расширения при постоянном давлении. Работа расширения положительна (
При изобарном охлаждении внутренняя энергия системы уменьшается. Количество теплоты, которое система отдаёт равно изменению внутренней энергии системы и работе по сжатию газа. В этом случае и количество теплоты, и работа системы отрицательны. Внутренняя энергия системы уменьшается.
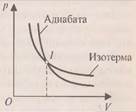
При изотермическом процессе температура постоянна, поэтому При адиабатическом процессе (рис.4) не происходит теплообмена с окружающей средой, поэтому количество теплоты При сжатии внешние силы совершают работу, а газ отрицательную; внутренняя энергия увеличивается, газ нагревается. Из графиков адиабатического и изотермического процессов, изображённых на рис.4, видно, что при адиабатном расширении совершается работа меньшая, чем при изотермическом, а при адиабатном сжатии – большая, чем при изотермическом. Полезно так же с учащимися решать графические задачи, требующие выяснения знаков величин, входящих в формулу первого закона термодинамики, например такую: на рис.5 изображён график зависимости давления от температуры. Как изменяется при этом изменении состояния газа его внутренняя энергия, совершается ли работа, получает или отдаёт система теплоту?
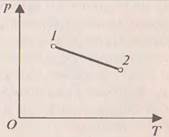 При переходе газа из состояния 1 в состояние 2 давление уменьшается, температура и внутренняя энергия газа увеличиваются. Объём газа также увеличивается ( При переходе газа из состояния 1 в состояние 2 давление уменьшается, температура и внутренняя энергия газа увеличиваются. Объём газа также увеличивается (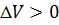 ), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно ( ), следовательно, газ совершает работу расширения, являющуюся положительной. Количество теплоты также положительно (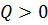 ), следовательно, газ получает некоторое количество теплоты. ), следовательно, газ получает некоторое количество теплоты.
Усвоение первого закона термодинамики способствует и решение вычислительных задач. Рассмотрение применения первого начала термодинамики к изопроцессам создает основу для понимания старшеклассниками принципов работы тепловых двигателей. Работа тепловых двигателей С тепловыми двигателями учащихся знакомят впервые в базовой школе, когда рассматривают общий принцип работы тепловых двигателей (совершение полезной работы за счёт внутренней энергии рабочего тела), изучают двигатель внутреннего сгорания и паровую турбину, а также вводят понятии о КПД тепловых двигателей. Основное внимание уделяют конструкции и принципам работы названных выше двигателей. В курсе физики старших классов рассматривают энергетические процессы, происходящие при работе тепловых двигателей. При изучении принципов работы тепловых двигателей, прежде всего, вводят понятие необратимости, формируют представление о втором законе термодинамики. Понятие необратимости раскрывают с помощью примеров: рассматривают абсолютно упругий удар, как пример обратимого явления, уточнив, что такой удар является идеализацией. Затем обращаются к таким явлениям, как пластическая деформация, диффузия и другие и вводят понятие необратимости процесса как такого, обратный которому самопроизвольно протекать не может. Далее подводят учащихся к формулировке второго закона термодинамики, говорят о том, что осуществить обратный процесс можно только в том случае, ели он будет являться частью другого процесса, связанного с затратами энергии. Так, можно восстановить форму тела при пластической деформации, но для этого необходимы внешние силы и затраты энергии. Изучение принципов работы тепловых двигателей можно построить по следующему плану: - обсуждение вопроса о том, что механическая работа может быть совершена за счёт внутренней энергии; устройство, в котором это происходит, называют тепловым двигателем; - обсуждение вопроса о том, что для непрерывной работы двигатель необходимо возвращать в первоначальное состояние, т.е. он должен быть циклическим; - обсуждение вопроса о том, что для получения положительной работы в первоначальное состояние двигатель должен возвращаться при более низкой температуре, следовательно, он должен иметь нагреватель, рабочее тело и холодильник. Далее учащимся говорят, что рабочее тело (им может быть пар, газ или специальная смесь) получается некоторое количество теплоты
Важным является вопрос о коэффициенте полезного действия. Как известно КПД – это отношение полезной работы к количеству теплоты, полученному от нагревателя:
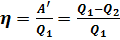 . .
Задача повышения КПД – одна из основных технических задач. Она связана прежде всего с созданием материалов, имеющих достаточную прочность при высоких температурах. В настоящее время температурные границы рабочего тела составляют 303 – 853 K. КПД идеальной машины, работающей по циклу Карно, при таких значениях температур равен 65%. Однако с учётом потерь КПД примерно равен 40%. Необходимо, чтобы школьники поняли принципиальное отличие решения задачи КПД тепловых двигателей от решения этой же задачи применительно к механическим и электрическим двигателям. КПД последних стремятся приблизить к 100%, а КПД тепловых двигателей к КПД идеальной машины Карно, работающей при тех же температурах холодильника и нагревателя. Поэтому повышение КПД тепловых двигателей связано с повышением температуры нагревателя и понижением температуры холодильника. Полезно привести значения мощностей и КПД некоторых тепловых двигателей. Например, карбюраторный двигатель внутреннего сгорания, установленный на автомобиле «Волга ГАЗ-24» имеет мощность 70кВт, КПД около 25%; мощность паровых турбин, установленных на электростанциях, составляет 500-800 МВт, а КПД 40%. В заключение изучения рассматриваемой темы обращают внимание учащихся на значение развития теплоэнергетики для народного хозяйства, в частности рассказывают о той экономии, которую даёт страну развитие теплоэлектроцентралей.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 794; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.216 (0.013 с.) |

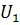 и
и 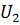 , то можно было бы отнять от системы разность энергий (
, то можно было бы отнять от системы разность энергий (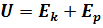 .
.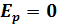 ;
; 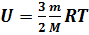 (для одноатомного газа).
(для одноатомного газа). ), если количество теплоты отдано системой.
), если количество теплоты отдано системой. , совершаемую внешними силами над системой, считают положительной (
, совершаемую внешними силами над системой, считают положительной ( ), если газ сжимается: работа внешних сил отрицательна, если газ расширяется (
), если газ сжимается: работа внешних сил отрицательна, если газ расширяется (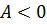 ).
).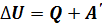 , где
, где 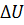 – изменение внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе:
– изменение внутренней энергии, равное разности значений внутренней энергии в конечном и в начальном состояниях. Эту формулу можно записать иначе: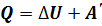 , (
, (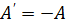 ).
).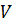 и температурой
и температурой 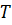 . Работа и количество теплоты характеризуют процесс изменения состояния. При одинаковом изменении состояния эти величины различны (в зависимости от способа перехода системы из одного состояния в другое), хотя сумма их будет одна и та же.
. Работа и количество теплоты характеризуют процесс изменения состояния. При одинаковом изменении состояния эти величины различны (в зависимости от способа перехода системы из одного состояния в другое), хотя сумма их будет одна и та же.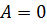 ,
, 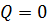 ,
, 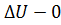 ). Внутренняя энергия системы не изменяется. Во втором случае система замкнутая (
). Внутренняя энергия системы не изменяется. Во втором случае система замкнутая (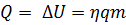 ): изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (
): изменение внутренней энергии равно количеству теплоты. В третьем случае система теплоизолированная (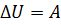 ); изменение внутренней энергии равно совершённой работе.
); изменение внутренней энергии равно совершённой работе.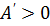 ) и равна
) и равна 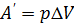 . Из рис.1 видно, что работа численно равна площади заштрихованного прямоугольника, Увеличение внутренней энергии при данном процессе равно:
. Из рис.1 видно, что работа численно равна площади заштрихованного прямоугольника, Увеличение внутренней энергии при данном процессе равно: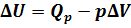 .
.
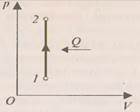
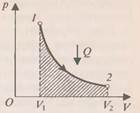
 При изохорном процессе (рис.2) работа равно нулю, так как объём газа не меняется (
При изохорном процессе (рис.2) работа равно нулю, так как объём газа не меняется (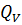 и изменение внутренней энергии положительны, т.е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.
и изменение внутренней энергии положительны, т.е. внутренняя энергия увеличивается, при охлаждении – внутренняя энергия уменьшается.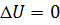 , т.е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идёт на работу, совершаемую газом при расширении. Работа численно равна площади заштрихованной фигуры (рис.3).
, т.е. внутренняя энергия не изменяется. Если система получает некоторое количество теплоты, то оно идёт на работу, совершаемую газом при расширении. Работа численно равна площади заштрихованной фигуры (рис.3).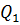 от нагревателя и расширяется. При расширении рабочее тело совершает работу. При сжатии рабочее тело отдаёт количество теплоты
от нагревателя и расширяется. При расширении рабочее тело совершает работу. При сжатии рабочее тело отдаёт количество теплоты 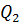 холодильнику. Температуры холодильника и нагревателя поддерживают постоянными, при этом температура нагревателя всегда выше температуры холодильника (
холодильнику. Температуры холодильника и нагревателя поддерживают постоянными, при этом температура нагревателя всегда выше температуры холодильника (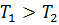 ).
).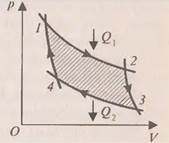 После этого целесообразно рассмотреть принцип работы идеальной тепловой машины Карно, рабочим телом в которой является идеальный газ. При расширении газа во время его контакта с нагревателем температуру поддерживают постоянной, во время сжатия и контакта с холодильником температура также постоянна, следовательно, расширение и сжатие происходит изотермически (на рис.6 соответственно изотермы 1-2 и 3-4). Но если температура расширения больше температуры сжатия, то необходимо произвести процессы, при которых температура меняется от
После этого целесообразно рассмотреть принцип работы идеальной тепловой машины Карно, рабочим телом в которой является идеальный газ. При расширении газа во время его контакта с нагревателем температуру поддерживают постоянной, во время сжатия и контакта с холодильником температура также постоянна, следовательно, расширение и сжатие происходит изотермически (на рис.6 соответственно изотермы 1-2 и 3-4). Но если температура расширения больше температуры сжатия, то необходимо произвести процессы, при которых температура меняется от 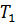 до
до 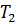 , а затем опять от
, а затем опять от 


