
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опытные законы идеального газаСодержание книги
Поиск на нашем сайте
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой: собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда; между молекулами газа отсутствуют силы взаимодействия; столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Модель идеального газа можно использовать при изучении реальных газов, т.к. они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов. Опытным путем, еще до появления молекулярно-кинетической теории, был установлен целый ряд законов, описывающих поведение идеальныхгазов, которые мы и рассмотрим. Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: pV = const при Т = const, m = const. (1.1)
Изотермы представляют собой гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс. Закон Гей–Люссака: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой: V=V0(1+at) при p=const, m=const, (1.2) p=p0(1+at) при V=const, m=const. (1.3) Процесс, протекающий при постоянном давлении, называется изобарным. На диаграмме в координатах V, t (рис. 47) этот процесс изображается прямой, называемой изобарой. Процесс, протекающий при постоянном объеме, называется изохорным. На диаграмме в координатах p, t (рис.48) он изображается прямой, называемой изохорой.
Из (1.2) и (1.3) следует, что изобары и изохоры пересекают ось температур в точке Т = t + Вводя в формулы (1.2) и (1.3) термодинамическую температуру, законам Гей-Люссака можно придать более удобный вид:
или
при р = const, m = const,
где индексы 1 и 2 относятся к произвольным состояниям, лежащим на одной изобаре или изохоре. Закон Авогадро: моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41×10-3 м3/моль. По определению в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е. p=р1+р2+…+рn, где р1, р2, …рn – парциальные давления – давления, которые оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси при той же температуре.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 522; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.175.83 (0.005 с.) |

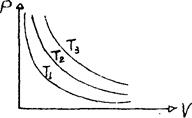 Рис. 46
Рис. 46
 .
. Рис. 47
Рис. 47
 Рис. 48
Рис. 48
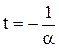 = -273.15°С, определяемой из условия 1+at=0. Если сместить начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 48), откуда
= -273.15°С, определяемой из условия 1+at=0. Если сместить начало отсчета в эту точку, то происходит переход к шкале Кельвина (рис. 48), откуда .
.
 (1.4)
(1.4)
 .
.


