
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ток в электролитах и газах. Потенциал ионизации. Закон ома для электролитов и газов. Электрофорез.Содержание книги
Поиск на нашем сайте
Если в электролит или расплав ввести две твердотельных пластинки (электроды) и подать на них напряжение, то возникает электрический ток, который создаётся направленным движением ионов. Достигнув соответствующих электродов, ионы отдают или приобретают электроны и превращаются в нейтральные атомы или молекулы. В результате химических реакций вторичные продукты либо оседают на электродах, либо переходят в раствор. Явление осаждения составных частей электролита на электродах получило название электролиза. Материалы, в которых при прохождении тока происходят химические превращения, относятся к проводникам второго рода. Количественно электролиз описывается законами Фарадея:
где m – масса осевшего на электроде вещества, k – его электрохимический эквивалент, i = f(t) – сила тока, t – время его протекания, F – число Фарадея (F = 96,497∙106 Кл/моль.), М – молярная масса вещества, z – валентность, F/z – называется химическим эквивалентом вещества. Если величина тока I в процессе электролиза не меняется, то (18) принимает вид: В растворе процессы диссоциации и рекомбинации идут параллельно. В конечном итоге в растворе при постоянных внешних условиях устанавливается динамическое равновесие. Этому состоянию соответствует определенная степень диссоциации, которую принято характеризовать коэффициентом диссоциации – α, который показывает долю распавшихся молекул растворенного вещества – α = n' / n0. При невысоких температурах ионы бывают окружены облепившими их ионами растворителя. Это явление получило название сольватации (для водных растворов – гидратации), а сам комплекс из иона и удерживаемой его силовым полем оболочки из молекул растворителя называют сольватом.Отношение называется подвижностью ионов, которая представляет среднюю скорость дрейфа заряженных частиц в поле с напряженностью 1 В/м). [b] = м2 / (В·с). Подвижность ионов b зависит от их природы, свойств растворителя и температуры. Для установившегося движения плотность тока в электролите будет: j = (n+ q+ b+ + n- q- b-)Е (22) Величина в скобках не зависит от напряженности поля – Е. Это значит, ток в электролитах подчиняется закону Ома. Если каждая молекула диссоциирует на два иона, то j = αnq(b+ + b-)Е. (23)
Выражение γ = αnq(b+ + b-) (24) представляет собой электропроводность электролита. Как видно из выражения (23), проводимость электролитов растет с повышением температуры, т.к. при этом увеличивается коэффициент диссоциации и подвижность ионов. Зависимость γ от концентрации довольно сложная (рис.): Для слабых растворов, когда α ≈ 1, γ растет пропорционально с. В дальнейшем с увеличением концентрации коэффициент диссоциации α убывает, поэтому рост проводимости замедляется, а затем даже начинает уменьшаться. Электрофорез – направленное движение заряженных частиц (ионов, капелек жидкости, взвешенных и коллоидных части) под воздействием электрического поля в какой-то среде. Скорость упорядоченного движения при электрофорезе определяется уравнением Смолуховского: где ε – диэлектрическая проницаемость среды, Е – напряженность электрического поля, η – вязкость среды, ξ – электрокинетический (дзета) потенциал. Газ становится проводником электричества только, когда некоторая часть его молекул ионизируется. Для ионизации газ надо подвергнуть воздействию какого-либо ионизатора: например, электрический разряд, рентгеновское излучение, радиации или УФ-излучение, пламя свечи. При ионизации газов происходит вырывание из внешней электронной оболочки атома или молекулы одного или нескольких электронов, что приводит к образованию свободных электронов и положительных ионов. Электроны могут присоединяться к нейтральным молекулам и атомам, превращая их в отрицательные ионы. Э лектрический ток в газах называется газовым разрядом. Т.о., ток в газах создается ионами обоих знаков и электронами. Газовый разряд при таком механизме будет сопровождаться переносом вещества, т.е. ионизированные газы относятся к проводникам второго рода. Для того чтобы оторвать от молекулы или атома один электрон, необходимо совершить определенную работу Аи, т.е. затратить определенную энергию. Эту энергию называют энергией ионизации, значения которой для атомов различных веществ лежат в пределах 4÷25 эВ. Количественно процесс ионизации принято характеризовать величиной, которая называется потенциал ионизации:
|
||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 745; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.186.156 (0.01 с.) |

 ,
,  , (19)
, (19)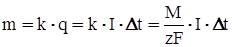 (20)
(20)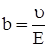 (21)
(21) , (25)
, (25) .
.


