Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электродные потенциалы и электродвижущие силыСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Если металлическую пластинку опустить в воду, то расположенные на ее поверхности катионы будут гидратироваться полярными молекулами воды и переходить в жидкость. При этом электроны, в избытке остающиеся в металле, заряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидрати-рованными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие
в растворе на металле где n - число электронов, принимающих участие в процессе. На границе металл-жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала - электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы, называемые стандартными электродными потенциалами Е°. Стандартным электродным потенциалом металла называет его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1М, и измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25 °С условно принимается равным нулю (Е° = 0; ΔG° = 0). Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов Е°, получаем так называемый "ряд напряжений" Положение того или иного металла в ряду напряжений характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества, и тем меньше окислительные свойства проявляет его ионы, и наоборот. Электродные потенциалы измеряет в приборах, которые получили название гальванических элементов. Окислительно-восстановительная реакция, которая лежит в основе работы гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение. В этом случае ΔG° < 0, так как ΔG° = - nFE0. Пример 1. Стандартный электродный потенциал никеля больше, чем у кобальта (табл. 4). Изменится ли это соотношение, если измерить потенциал никеля в растворе его соли с концентрацией 0,001 М, а кобальта - 0,1 М? Решение. Электродный потенциал металла Е зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста
где Е° - стандартный электродный потенциал; n - число электронов, принимающих участие в процессе; С - концентрация (при точных вычислениях - активность) соли, моль/л, Е° для никеля и кобальта соответственно равны - 0,25 и - 0,277 В. Определим электродные потенциалы этих металлов при указанных в примере концентрациях:
Таким образом, при изменившихся концентрациях потенциал кобальта стал больше потенциала никеля. Пример 2. Магниевую пластинку опустили в раствор соли магния. При этом электродный потенциал магния оказался равен - 2,41 В. Вычислите концентрацию раствора. Решение. Подобные задачи решаются также на основании уравнения Нернста (см. пример 1):
Пример 3. Составьте схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их солей с активной концентрацией I моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальванической элементе и вычислите его ЭДС. Решение. Схема данного гальванического элемента
Вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черточки - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал - 2,30 В и является анодом, на котором протекает окислительный процесс:
Цинк, потенциал которого -0,763 В, - катод, т.е. электрод, на котором протекает восстановительный процесс:
Уравнение окислительно-восстановительной реакции, которая лежит в основе работы данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Для определения электродвижущей силы - ЭДС гальванического элемента - из потенциала катода следует вычесть потенциал анода. Так как концентрация солей в растворах равна 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Стандартные электродные потенциалы Е° некоторых веществ (ряд напряжений)
При решении задач этого раздела см. табл. 4. 141. В два сосуда с голубым раствором медного купороса поместили: в первый - цинковую пластинку, а во второй - серебряную. В каком сосуде раствор постепенно обесцвечивается? Почему? Составьте электронные и молекулярное уравнения соответствующих реакций. 142. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: a) CuSO4; б) MgSO4; Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. 143. При какой концентрации ионов Zn2+, моль/л, потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала. Ответ: 0,30 моль/л. 144. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: a) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций. 145. Марганцевый электрод в растворе его соли имеет потенциал - 1,23 В. Вычислите концентрацию ионов Мn2+ в моль/л. Ответ: 1,89*10-2 моль/л. 146. Потенциал серебряного электрода в растворе АgNO3 составил 95 % от величины его стандартного потенциала. Чему равна концентрация ионов Ао+ в моль/л? Ответ: 0,20 моль/л. 147. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком отношении должны быть концентрации ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми? Ответ: CNi2+; CCo2+ = 0,117. 148. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде. 149. При какой концентрации ионов Си2+ в моль/л значение потенциала медного электрода становится равным стандартному потенциалу водородного элемента? Ответ: 1,89*10-12 моль/л. 150. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных первый - в 0,01 н, а второй - в 0,1 н растворы AgNO3. Ответ: 0,058 В. 151. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод - в 0,01 М растворе сульфата никеля. Ответ: 0,029 В. 152. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Mg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В. 153. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом - анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. 154. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на катоде и на аноде. 155. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = I моль/л. Изменится ли величина ЭДС, если концентрацию раствора каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В. 156. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и катоде. Какой концентрации надо было бы взять раствор ионов железа, чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/л? Ответ: 7,3*10-15 моль/л. 157. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni + Pb(NO3)2 = Ni(NO3)2 + Pb. Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/л, [Рb2+] = 0,0001 моль/л. Ответ: 0,065 В. 158. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора? 159. Какие химические процессы протекают на электродах при зарядке и разрядке кадмий-никелевого аккумулятора? 160. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
ЭЛЕКТРОЛИЗ
Пример 1. Сколько граммов меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч при силе тока 4А? Решение. Согласно законам Фарадея
где m - масса вещества, окисленного или восстановленного на электроде; Э - эквивалент вещества; i - сила тока, A; t - продолжительность электролиза, с; F - число Фарадея, равное 96500 Кл (А*с). Эквивалентная масса меди в СuSO4 равна 63,54: 2 = 31,77 г. Подставив в формулу (1) значения Э = 31,77 г, i = 4 A, t = 60*60 = 3600 с, получим:
Пример 2. Вычислить эквивалент металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделилось 11,742 г металла. Решение. Из формулы (1) Э = 11,742*96500/3880 = 29,35 г, где –m = 11,742 г: it = Q = 3880 Кл. Пример 3. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях? Решение. Из формулы (1) i = m*F/Э*t. Так как количество водорода дано в объемных единицах измерения, то отношение m/Э заменяем отношением
Объем эквивалента водорода при н.у. равен половине молекулярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения
Пример 4. Сколько граммов едкого кали образовалось у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода, измеренного при нормальных условиях? Решение. Объем эквивалента кислорода при нормальных условиях 22,4/4 = 5,6 л. Следовательно, 11,2 л составляют 2 экв кислорода. Стойко же, т.е. 2 экв КОН образовалось у катода, или 56,11*2 = 112,22 г (56,11 г - масса эквивалента КОН). 161. Электролиз раствора K2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов происходивших на электродах, вычислите объемы выделившихся на электродах веществ. 162. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов АlСl3 и NiSO4. В обоих случаях анод угольный. 163. При электролизе раствора CuSO4 на аноде выделилось 168 см3 кислорода, измеренного при н.у. Сколько граммов меди выделилось на катоде? 164. Сколько граммов воды разложилось при электролизе раствора Na2SO4 при силе тока 7 А в течение 5 ч? 165. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Сколько граммов серебра выделилось на катоде? 166. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалент металла. 167. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН, расплава КОН. 168. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода, измеренного при н.у. Вычислите силу тока. 169. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора Al(SO4)3 в случае угольного анода; в случае алюминиевого анода. 170. Какие вещества и в каком количестве выдавятся на угольных электродах при электролизе раствора NаJ в течение 2,5 ч, если сила тока равна 6 А? 171. При электролизе; раствора AgNO3 масса серебра анода уменьшилась на 5,4 г. Сколько кулонов электричества израсходовано на этот процесс? 172. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора КВr в течение 1 ч 35 мин при силе тока 15 А? 173. Составьте электронные уравнения процессов, происходящих при электролизе раствора CuCl2, если анод медный; если анод угольный? 174. При электролизе раствора CaCl2 израсходовано 10722,2 Кл электричества. Вычислите массы выделившихся на угольных электродах и образующегося возле катода веществ. 175. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КСl; расплава КСl. 176. Сколько времени нужно проводит электролиз раствора электролита при силе тока 5 А, чтобы на катоде выделилось 0,1 экв вещества? 177. При электролизе растворов MgSO4 и ZnCl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Сколько граммов вещества выделилось на другом катоде; на анодах? 178. Чему равна сила тока, если при электролизе раствора МgСl2 в течение 30 мин на катоде выделилось 8,4 л водорода, измеренного при н.у. Вычислите массу вещества выделившегося на аноде. 179. Сколько граммов H2SO4 образуется возле анода при электролизе раствора Na2SO4, если на аноде выделится 1,12 л кислорода, измеренного при н.у.? Вычислите массу вещества, которое выделится на катоде. 180. Вычислите силу тока, зная, что при электролизе раствора КОН в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г кислорода. Какое вещество и в каком количестве выделилось на катоде.
КОРРОЗИЯ МЕТАЛЛОВ
181. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 182. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. 183. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 184. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции. 185. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты никеля в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 186. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным? Составьте электронные уравнения соответствующих процессов. 187. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов. 188. В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов. 189. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильно кислой среде. 190. Какое покрытие металла называют анодным и какое катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильно кислой среде. 191. Железное изделие покрыли кадмием. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 192. Железное изделие покрыли свинцом. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях? 193. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа? 194. В обычных условиях во влажном воздухе оцинкованное железо при нарушении покрытия не ржавеет, тогда как при температурах выше 70°С оно покрывается ржавчиной. Чем это можно объяснить? Составьте электронные уравнения анодного и катодного процессов коррозии оцинкованного железа в первом и во втором случаях. 195. Если пластинку из чистого железа опустить в соляную кислоту, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов. 196. Цинковую к железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионные уравнения реакций, происходящие на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником? 197. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов. 198. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов. 199. Железные бочки применяют для транспортировки концентрированной серной кислоты, но после освобождения от кислоты бочки часто совершенно разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом и что катодом? Составьте электронные уравнения соответствующих процессов. 200. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 664; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.142.113 (0.009 с.) |

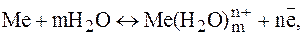
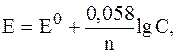

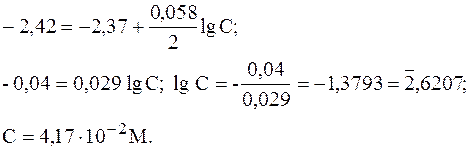

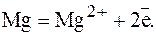 (1)
(1)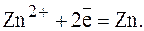 (2)
(2)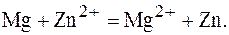
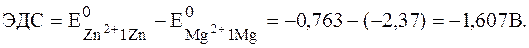
 (1)
(1)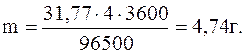
 - объем водорода, л;
- объем водорода, л; 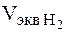 - объем эквивалента водорода, л, тогда
- объем эквивалента водорода, л, тогда
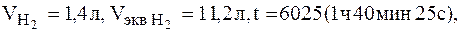 находим:
находим: