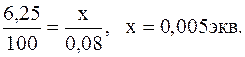Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жесткость воды и методы ее устраненияСодержание книги Поиск на нашем сайте
Пример 1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НС03)2. Решение. В 1л воды содержится 202,5: 500 = 0,405 г Ca(НСO3), что составляет 0,405: 81 0,005 экв, или 5 мэкв (81 - эквивалент Са(НСО3)2. Следовательно, жесткость воды равна 5 мэкв. Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 мэкв? Решение. Масса моля CaSO4 136,14г; эквивалент равен половине моля, т.е. 68,07 г, а миллиэквивалент - 68,07 мг. В 1 м3 воды с жесткостью 4 мэкв содержится 4*1000 = 4000 мэкв или 4000*68,07 = 272280 мг = 272,28 г CaSO4. Пример 3. Сколько граммов соды надо прибавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мэкв? Решение. В 500 л воды содержится 500*5 = 2500 мэкв или 2,5 экв солей, обусловливающих жесткость воды. Для устранения следует прибавить 2,5*53 = 132,5 г соды (53 - масса эквивалента Na2CO4). Пример 4. Вычислить карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора НСl. Решение. Вычисляем нормальность раствора гидрокарбоната кальция. Обозначив число эквивалентов растворенного вещества в 1 л раствора, т.е. нормальность, через х, составляем пропорцию:
Таким образом, в 1 л исследуемой воды содержится 0,005*1000 = 5 мэкв гидрокарбоната кальция или 5 мэкв Са2+ - ионов. Карбонатная жесткость воды 5 мэкв. Приведенные примеры решают, используя формулу: Ж = m/Э*V, где m - масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг; Э - эквивалент этого вещества; V- объем воды, л; Ж - жесткость воды. Решение примера 1. Ж = m/Э*V = 202500/81*500 = 5 мэкв, 81 - эквивалент Са(НС03)2, равный половине его моля. Решение примера 2. Из формулы Ж = m/Э*V m = 4*68,07*1000 = 272280 мг = 272,28 г. 201. Сколько граммов Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 мэкв? 202. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. 203. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н. раствора HCl. 204. В 1 л воды содержится 36,47 ммоль ионов магния и 50,1 ммоль ионов кальция. Чему равна жесткость этой воды? 205. Сколько граммов карбоната натрия надо прибавить к 400 л воды ее жесткость, равную 3 мэкв? 206. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Сколько граммов сульфата магния содержится в 300 л этой воды? 207. Вычислите жесткость воды, зная, что, в 600 л ее содержится 67,5 г гидрокарбоната магния и 61,2 г сульфата кальция. 208. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? 209. Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 мэкв. Сколько см3 0,1 н. раствора НСl потребуется для реакции с гидрокарбонатом кальция, содержащемся в 75 см3 этой воды? 210. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды. 211. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 мэкв. Сколько граммов гидрокарбоната магния содержится в 200 л этой воды? 212. К 1 м3 жесткой воды прибавили 132*5 г карбоната натрия. На сколько миллиэквивалентов понизилась жесткость воды? 213. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? 214. Сколько граммов СаSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 мэкв? 215. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв. Сколько граммов гидрокарбоната кальция содержится в 500 л этой воды? 216. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. 217. Сколько граммов карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить ее жесткость, равную 4 мэкв? 218. К 100 л жесткой воды прибавили 12,96 г гидроксида кальция. На сколько миллиэквивалентов понизилась карбонатная жесткость? 219. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? 220. Сколько граммов гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв?
ОГЛАВЛЕНИЕ
Предисловие.......................................................................................3 Общие методические указания........................................................3 Программа.........................................................................................5 Таблица контрольных заданий.........................................................9 Контрольные задания..................................................................... 12 Эквиваленты простых и сложных веществ. Закон эквивалентов. 12 Строение атомов..............................................................................15 Периодическая система элементов Д.И. Менделеева ………17 Химическое строение молекул. Конденсированное состояние. 19 Энергетика химических процессов (термохимические расчеты). 20 Химическое сродство..................................................................... 27 Химическая кинетика и равновесие............................................. 33 Электродные потенциалы и электродвижущие силы..................37 Электролиз...................................................................................... 42 Коррозия металлов..........................................................................45 Жесткость воды и методы ее устранения................................... 47
Химия: Методические указания, программа и контрольные задания для студентов-заочников специальности 060800 "Экономика и управление на предприятиях" (в машиностроении).
Виталий Андреевич Татаринов
Научный редактор В.Н. Шалаевская Редактор издательства НД.Сацкова Печать В.Д. Татаринов
Темплан 1999 г., п. 23 Лицензия № 020381 от 24,04.97 г. Подписано в печать 09.04.99 Формат 60x84 I/I6 Бумага типографская № 2 Офсетная печать Печ.л. 2009 Уч.-*изд.л. 2,09 Т. 100 экз. Заказ^/f Бесплатно Брянский государственный технический университет 241035, Брянск, бульвар 50-%нетия Октября, 7, БГТУ Лаборатория оперативной полиграфии БГТУ, ул. Институтская, 16,
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 596; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |