

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Раздел 2. Окислительно-восстановительные реакции
Похожие статьи вашей тематики
В задачах (286-369) подберите коэффициенты к уравнениям окислительно-восстановительных реакций, используя метод электронно-ионного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления.
| №
п/п
| Уравнение окислительно-восстановительной реакции.
| |
| KMnO4 + HCl ® Cl2 + MnCl2 + KCl + H2O
| |
| MnO2 + HCl ® Cl2 + MnCl2 + H2O
| |
| KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O
| |
| Au + HNO3 + HCl ® H[AuCl4] + NO + H2O
| |
| Si + HNO3 + HF ® H2[SiF6] + NO + H2O
| |
| K2MnO4 + H2O ® KMnO4 + MnO2 + KOH
| |
| KClO3 + KJ + H2SO4 ® KCl + J2 + K2SO4 + H2O
| |
| K2Cr2O7 + KNO2 + H2SO4 ® Cr2(SO4)3 + KNO3 + K2SO4 + H2O
| |
| Na2SO3 + H2S + H2SO4 ® Na2SO4 + S + H2O
| |
| KMnO4 + H2S + H2SO4 ® MnSO4 + S + K2SO4 + H2O
| |
| KMnO4 + C6H12O6 + H2SO4 ® MnSO4 + CO2 + K2SO4 + H2O
| |
| H2O2 + FeSO4 + H2SO4 ® Fe2(SO4)3 + H2O
| |
| K2Cr2O7 + H2O2 + H2SO4 ® Cr2(SO4)3 + O2 + K2SO4 + H2O
| |
| Br2 + K3[Cr(OH)6] + KOH ® KBr + K2CrO4 + H2O
| |
| Cl2 + NaOH ® NaClO3 + NaCl + H2O
| |
| Cu + HNO3 ® Cu(NO3)2 + NO + H2O
| |
| Fe + HNO3 ® Fe(NO3)3 + NO2 + H2O
| |
| KMnO4 + K2HPO3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
| |
| Zn + H2SO4 ® ZnSO4 + H2S + H2O
| |
| KBrO3 + KBr + H2SO4 ® Br2 + K2SO4 + H2O
| |
| HJO3 + P + H2O ® HJ + H3PO4
| |
| Cl2 + H2S + H2O ® HCl + H2SO4
| |
| KMnO4 + Na2SO3 + H2O ® MnO2 + Na2SO4 + KOH
| |
| HNO3 + PbS¯ ® NO + S + Pb(NO3)2 + H2O
| |
| HNO3 + P + H2O ® NO + H3PO4
| |
| KMnO4 + K2SO3 + KOH ® K2MnO4 + K2SO4 + H2O
| |
| HNO3 + Cu2O ® NO + Cu(NO3)2 + H2O
| |
| HNO3 + Ca ® NH4NO3 + Ca(NO3)2 + H2O
| |
| NaMnO4 + Na2S + H2SO4 ® MnSO4 + S + Na2SO4 + H2O
| |
| KMnO4 + HBr ® MnBr2 + Br2 + KBr + H2O
| |
| HClO3 + P + H2O ® HCl + H3PO4
| |
| KMnO4 + H3AsO3 + H2SO4 ® MnSO4 + H3AsO4 + K2SO4 + H2O
| |
| Br2 + NaCrO2 + NaOH ® NaBr + Na2CrO4 + H2O
| |
| Zn + HNO3 ® Zn(NO3)2 + N2O + H2O
| |
| KClO3 + FeSO4 + H2SO4 ® KCl + Fe2(SO4)3 + H2O
| |
| K2Cr2O7 + HCl ® CrCl3 + Cl2 + KCl + H2O
| |
| CrO3 + HCl ® CrCl3 + Cl2 + H2O
| |
| KMnO4 + Cd + H2SO4 ® MnSO4 + CdSO4 + K2SO4 + H2O
| |
| Cr2O3 + KClO3 + KOH ® K2CrO4 + KCl + H2O
| |
| PbO2 + MnSO4 + HNO3 ® Pb(NO3)2 + HMnO4 + PbSO4¯ + H2O
| |
| Na2Cr2O7 + FeSO4 + H2SO4 ® Cr2(SO4)3 + Fe2(SO4)3 + Na2SO4 + H2O
| |
| KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
| |
| KMnO4 + H2C2O4 + H2SO4 ® MnSO4 + CO2 + K2SO4 + H2O
| |
| K2Cr2O7 + H2[HPO3] + H2SO4 ® Cr2(SO4)3 + H3PO4 + K2SO4 + H2O
| |
| PbO2 + HNO2 + H2SO4 ® PbSO4¯ + HNO3 + H2O
| |
| HBrO3 + SO2 + H2O ® Br2 + H2SO4
| |
| KMnO4 + SO2 + KOH ® MnO2 + K2SO4 + H2O
| |
| KMnO4 + NaNO2 + KOH ® K2MnO4 + NaNO3 + H2O
| |
| Mg + H2SO4 ® MgSO4 + H2S + H2O
| |
| KСlO3 + HCl ® Cl2 + KCl + H2O
| |
| HСlO + J2 + H2O ® HCl + HJO3
| |
| NaBrO3 + NaBr + H2SO4 ® Br2 + Na2SO4 + H2O
| |
| Al + H2O + NaOH ® Na[Al(OH)4] + H2
| |
| KNO2 + KJ + H2SO4 ® NO + J2 + K2SO4 + H2O
| |
| K2Cr2O7 + + SnCl2 + HCl ® CrCl3 + SnCl4 + KCl + H2O
| |
| KMnO4 + K2SO3 + NaOH ® K2MnO4 + Na2MnO4 + K2SO4 + H2O
| |
| KMnO4 + H2O2 ® MnO2 + O2 + KOH + H2O
| |
| H2O2 + CrCl3 + NaOH ® Na2CrO4 + NaCl + H2O
| |
| H2O2 + Hg(NO3)2 + NaOH ® O2 + Hg + NaNO3 + H2O
| |
| HJO3 + H2O2 ® J2 + O2 + H2O
| |
| KMnO4 + Zn + H2SO4 ® MnSO4 + ZnSO4 + K2SO4 + H2O
| |
| NaClO + KJ + H2SO4 ® NaCl + J2 + K2SO4 + H2O
| |
| MnO2 + H2C2O4 + H2SO4 ® MnSO4 + CO2 + H2O
| |
| PbO2 + Mn(NO3)2 + HNO3 ® Pb(NO3)2 + HMnO4 + H2O
| |
| Na2WO4 + SnCl2 + HCl ® W2O5 + SnCl4 + NaCl + H2O
| |
| KClO3 + MnSO4 + KOH ® K2MnO4 + KCl + K2SO4 + H2O
| |
| Na2SeO3 + Cl2 + NaOH ® Na2SeO4 + NaCl + H2O
| |
| HNO3 + FeCl2 + HCl ® NO + FeCl3 + H2O
| |
| KMnO4 + PH3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O
| |
| MnSO4 + H2O2 + KOH ® MnO2 + K2SO4 + H2O
| |
| KClO3 + K2S + H2SO4 ® KCl + S + K2SO4 + H2O
| |
| KNO3 + KJ + HCl ® NO + J2 + KCl + H2O
| |
| K2Cr2O7 + Al + H2SO4 ® Cr2(SO4)3 + Al2(SO4)3 + K2SO4 + H2O
| |
| Bi(NO3)3 + K2SnO2 + KOH ® Bi + K2SnO3 + KNO3 + H2O
| |
| NaNO3 + Al + NaOH ® NH3 + Na[Al(OH)4]
| |
| HNO3 + Ti + H2O ® NO + H2TiO3¯
| |
| Cl2 + K2S + KOH ® KCl + K2SO4 + H2O
| |
| KNO3 + Cr2O3 + KOH ® KNO2 + K2CrO4 + H2O
| |
| Cl2 + CrCl3 + NaOH ® NaCl + Na2CrO4 + H2O
| |
| S + KOH ® K2SO3 + K2S + H2O
| |
| KMnO4 + MnSO4 + KOH ® MnO2 + K2SO4 + H2O
| |
| AgNO3 + H2O2 + KOH ® Ag + KNO3 + O2 + H2O
| |
| KBrO + MnCl2 + KOH ® KBr + MnO2 + KCl + H2O
| |
| K2MnO4 + K2S + H2O ® MnO2 + S + KOH
|
Раздел 3. Химическая термодинамика.
Первый закон термодинамики.
В задачах (370-394) определите стандартный тепловой эффект реакции при:
а) изобарном её проведении - D r H 0298;
б) изохорном её проведении - D r U 0298
(стандартные значения термодинамических функций приведены в приложении)
| №
п/п
| Уравнение реакции
| |
| 4HCl (г) +O2 (г) = 2H2O (г) + 2Cl2 (г)
| |
| CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (ж)
| |
| Fe3O4 (к) + 4CO (г) = 3Fe (к) + 4CO2 (г)
| |
| 3Fe3O4 (к) + 8Al (к) = 4Al2O3 (к) + 9Fe (к)
| |
| 3H2O (г) + 2Al (к) = Al2O3 (к) + 3H2 (г)
| |
| Fe3O4 (к) + 4H2 (г) = 3Fe (к) + 4H2O (г)
| |
| S (к)+ 2N2O (г) = SO2 (г) + 2N2 (г)
| |
| H2S (г) + Cl2 (г) = 2HCl (г) + S (к)
| |
| CO (г) + H2O (г) = CO2 (г) + H2 (г)
| |
| Fe2O3 (к) + 3CO (г) = 2Fe (к) + 3CO2 (г)
| |
| 2PbS (к) + 3O2 (г) = 2PbO (к) + 2SO2 (г)
| |
| CaCO3 (к) = CaO (к) + CO2 (г)
| |
| Fe (к) + H2O (г) = FeO (к) + H2 (г)
| |
| 2CO2 (г) = 2CO (г) + O2 (г)
| |
| Fe2O3 (к) + CO (г) = 2FeO (к) + CO2 (г)
| |
| PbO (к) + CO (г) = Pb (к) + CO2 (г)
| |
| C2H4 (г) + H2O (г) = C2H6O (г)
| |
| FeO (к) + Mn (к) = MnO (к) + Fe (к)
| |
| 2FeO (к) + Si (к) = 2Fe (к) + SiO2 (к)
| |
| FeO (к) + C (к) = Fe(к) + CO (г)
| |
| 3Fe2O3 (к) + H2 (г) = 2Fe3O4 (к) + H2O (г)
| |
| GeO2 (к) + 2Cl2 (г) + 2C (к) = GeCl4 (г) + 2CO (г)
| |
| CH4 (г) + H2O (г) = CO (г) + 3H2 (г)
| |
| WO3 (г) + 3H2 (г) = W (к) + 3H2O (г)
| |
| 2MoO2 (к) + 6CO (г) = Mo2C (к) + 5CO2 (г)
|
В задачах (395-414) вычислите, сколько теплоты выделится при полном сгорании указанного количества вещества при стандартных условиях. Учтите, что в продуктах сгорания углерод находится в виде углекислого газа, водород – водяного пара, сера – сернистого газа, азот выделяется в свободном состоянии.
| №
п/п
| Вещество
| Количество
вещества
| №
п/п
| Вещество
| Количество
вещества
| |
| CH4
| 3 моль
|
| C6H5NO2
| 2 моль
| |
| C2H4
| 20 л
|
| C5H5N
| 10 моль
| |
| C2H2
| 5 м3
|
| CH4N2O
| 3 м3
| |
| C2H6
| 20 моль
|
| C10H8
| 50 дм3
| |
| C3H8
| 5 дм3
|
| CH4O
| 4 моль
| |
| H2S
| 8 моль
|
| C3H6O
| 6 м3
| |
| CS2
| 40 л
|
| C4H10
| 9 моль
| |
| C3H6
| 7 моль
|
| CH3COOH
| 40 л
| |
| C4H8
| 6 м3
|
| C2H5OH
| 5 моль
| |
| CH2O
| 25 л
|
| CH4O
| 80 м3
|
В задачах (415-427) по заданным термохимическим уравнениям рассчитайте стандартную энтальпию реакции образования указанного вещества из простых веществ.
| №
п/п
| Термохимические уравнения реакций
D r H o, кДж
| Вещество
| |
| (I) 4As(т) + 3O2(г) = 2As2O3( D r H oI = -1328 (II) As2O3(т) + O2(г) = As2O5(т); D r H oII = -261
|
As2O5
| |
| (I) 2As(т) + 3F2(г) = 2AsF3(г); D r H oI = -1842 (II) AsF5(г) = AsF3(г) + F2(г); D r H oII = +317
|
AsF5
| |
| (I) 2С (т) + O2(г) = 2СO2(г); D r H oI = -220 (II) СO(г) + F2(г) = COF2(г); D r H oII = -525
|
COF2
| |
| (I) 2Сr(т) + 3F2(г) = 2СrF3(т); D r H oI = -2224 (II) 2СrF3(т) + Cr(т) = 2CrF2(т); D r H oII = -38
|
CrF2
| |
| (I) 2P(т) + 3Cl2(г) = 2PCl3(г); D r H oI = -574
(II) PCl5(г) = PCl3(г) + Cl2(г); D r H oII = +88
|
PCl5
| |
| (I) 2Pb(т) + O2(г) = 2PbO(т); D r H oI = - 438
(II) 2PbO2(т) = 2PbO(т) + O2(г); D r H oII = +116
|
PbO2
| |
| (I) Zr(т) + ZrCl4(г) = 2ZrCl2(г); D r H oI = +215 (II) Zr (т) +2Cl2(г) = ZrCl4(г); D r H oII = + 867
|
ZrCl2
| |
| (I) 2ClF5(г) = Cl2F6(г) + 2F2(г); D r H oI = +152
(II) Сl2(г) + 5F2(г) = 2ClF5(г); D r H oII = - 478
|
Cl2F6
| |
| (I) Ce(т) + O2(г) = CeO(т); D r H oI = - 1090
(II) 3CeO2(т) + Ce(т) = 2Ce2O3(т); D r H oII = - 332
|
Ce2O3
| |
| (I) CuCl2(т) + Cu(т) = 2CuCl(т); D r H oI = - 56
(II) Cu(т) + Cl2(т) = СuCl2(т); D r H oII = - 216
|
CuCl
| |
| (I) HgBr2(т) + Hg(ж) = Hg2Br2(т); D r H oI = - 38
(II) HgBr2(т) = Hg(ж) + Br2(ж); D r H oII = + 169
|
Hg2Br2
| |
| (I) Ir(т) + 2S(г) = IrS2(т); D r H oI = - 144 (II) 2IrS2(т) = Ir2S3(т) + S(т); D r H oII = + 43
|
Ir2S3
| |
| (I) 2Fe(т) + O2(г) = 2FeO(т); D r H oI = - 532
(II) 4FeO(т) + O2(г) = 2Fe2O3(т); D r H oII = -584
|
Fe2O3
|
Второй закон термодинамики
В задачах (428-443) определите энтропию 1 моль газа при давлении P и стандартной температуре. Укажите, увеличивается или уменьшается энтропия вещества при изменении давления от стандартного к заданному. Значения энтропии при стандартных условиях возьмите из приложения, примите, что данные вещества подчиняются законам идеального газа.
| №
п/п
| Газ
| P×10-5, Па
| №
п/п
| Газ
| P×10-5, Па
| |
| H2
| 3,039
|
| C2H4
| 0,601
| |
| H2O
| 10,130
|
| N2
| 0,507
| |
| He
| 1,519
|
| O2
| 0,840
| |
| CH4
| 8,100
|
| F2
| 1,722
| |
| CO
| 0.405
|
| Cl2
| 1,925
| |
| NO
| 1,823
|
| Ne
| 3,039
| |
| CO2
| 1,317
|
| Ar
| 2,533
| |
| C2H6
| 0,709
|
| Kr
| 1,013
|
В задачах (444-461) рассчитайте энтропию 1 моль вещества в двухкомпонентном растворе при известной массовой доле ω, полагая, что раствор является идеальным.
| № п/п
| Вещество
| ω,
%
| Растворитель
| №
п/п
| Вещество
| ω,
%
| Растворитель
| |
| C
| 0,36
| Fe
|
| Cu
| 5,8
| Sn
| |
| Al
| 13,5
| Cu
|
| Mn
| 1,3
| Cu
| |
| Sn
| 4,5
| Cu
|
| Co
| 10,5
| W
| |
| Cr
|
| Ni
|
| Fe
| 3,1
| Ni
| |
| Zn
| 3,8
| Cu
|
| Ni
| 5,2
| Cu
| |
| Be
| 2,7
| Cu
|
| Sb
| 15,7
| Pb
| |
| Si
| 13,9
| Fe
|
| Rh
| 10,0
| Pt
| |
| Si
| 17,5
| Al
|
| Ir
| 15,9
| Pt
| |
| Al
| 1,8
| Ni
|
| Ag
| 12,5
| Au
|
В задачах (462-480) рассчитайте энтропию каждого компонента в газовой смеси, подчиняющейся законам идеальных газов, и энтропию смеси.
| №
п/п
| 1-й компонент
| 2-й компонент
| 3-й компонент
| | Символ
| n 1, моль
| Символ
| n 2, моль
| Символ
| n 3, моль
| |
| H2
| 1,0
| N2
| 2,0
| Ar
| 5,0
| |
| He
| 1,5
| H2
| 2,5
| N2
| 4,0
| |
| N2
| 2,0
| Ne
| 3,0
| Kr
| 3,0
| |
| Ar
| 3,5
| He
| 2,0
| H2
| 2,5
| |
| Ne
| 2,0
| N2
| 1,5
| O2
| 3,5
| |
| O2
| 1,5
| Ne
| 1,0
| Ar
| 2,5
| |
| H2
| 2,0
| N2
| 3,0
| Ar
| 4,0
| |
| O2
| 1,0
| F2
| 2,5
| N2
| 4,5
| |
| He
| 2,0
| Cl2
| 3,0
| Ne
| 1,5
| |
| Ne
| 2,5
| H2
| 2,0
| O2
| 3,5
| |
| N2
| 3,0
| Kr
| 2,0
| Ne
| 2,0
| |
| O2
| 2,0
| He
| 1,5
| F2
| 3,5
| |
| H2
| 1,0
| Ne
| 3,0
| N2
| 5,0
| |
| Kr
| 0,5
| F2
| 2,5
| He
| 2,5
| |
| Ar
| 2,0
| H2
| 1,0
| Ne
| 1,5
| |
| N2
| 3,5
| F2
| 1,5
| Kr
| 2,0
| |
| Ne
| 1,5
| He
| 2,5
| H2
| 3,5
| |
| O2
| 2,0
| N2
| 2,0
| Ar
| 4,0
| |
| H2
| 1,0
| N2
| 3,0
| He
| 2,0
|
В задачах (481-505) рассчитайте стандартное изменение энергии Гиббса D r G T 0 и константу равновесия K 0 при заданной температуре T. Укажите, в каком направлении протекает реакция при данной температуре и направление смещения равновесия при увеличении температуры. При обосновании направления смещения равновесия используйте уравнение изобары химической реакции.
| №
п/п
| Уравнение реакции
| Т, К
| |
| 2H2(г) + CO(г) ó CH3OH(ж)
|
| |
| 4HCl(г) + O2(г) ó 2H2O(г) + 2Cl2(г)
|
| |
| 2N2(г) + 6H2O(г) ó 4NH3(г) + 3O2(г)
|
| |
| 4NO(г) + 6H2O(г) ó 4NH3(г) + 5O2(г)
|
| |
| 2NO2(г) ó 2NO(г) + O2(г)
|
| |
| N2O4(г) ó 2NO2(г)
|
| |
| S2(г) + 4H2O(г) ó 2SO2(г) + 4H2(г)
|
| |
| S2(г) + 4CO2(г) ó 2SO2(г) + 4CO(г)
|
| |
| 2SO2(г) + O2(г) ó 2SO3(г)
|
| |
| CO2(г) + H2(г) ó CO(г) + H2O(г)
|
| |
| SO2(г) + Cl2(г) ó SO2Cl2(г)
|
| |
| CO(г) + 3H2(г) ó CH4(г) + H2O(г)
|
| |
| 4CO(г) + SO2(г) ó S2(г) + 4CO2(г)
|
| |
| C2H5OH(г) ó C2H4(г) + H2O(г)
|
| |
| FeO(k) + CO(г) ó Fe(k) + CO2(г)
|
| |
| WO3(k) + 3H2(г) ó W(k) + 2H2O(г)
|
| |
| NH4Cl(k) ó NH3 + HCl
|
| |
| Mg(OH)2(k) ó MgO(k) + H2O(г)
|
| |
| H2O(г) + C(графит) ó CO(г) + H2(г)
|
| |
| PbO2(к) + C(графит) ó Pb(к)+ CO2(г)
|
| |
| MnO2(k) + 2H2 ó Mn(k) + 2H2O(г)
|
| |
| 3Fe(к)+ 4H2O(г) ó Fe3O4(к) + 4H2(г)
|
| |
| C6H6(г) + 3H2(г) ó C6H12(г)
|
| |
| NiOH2(k) ó NiO(k) + H2O(г)
|
| |
| 2CrCl3(k) ó 2CrCl2(k) + Cl2(г)
|
|
В задачах (506-513) для газофазной реакции А + В = С +D рассчитайте константу равновесия при температуре Т и равновесный состав системы при этой температуре, если известны D r G 0 T и начальные концентрации исходных веществ С 0. Концентрация продуктов реакции в начальный момент равна нулю.
| №
п/п
| Т, К
| D r G 0 T, кДж/моль
| С 0, моль/л
| № п/п
| Т, К
| D r G 0 T, кДж/моль
| С 0,
моль/л
| | А
| В
|
| А
| В
| |
|
| - 14,1
|
|
|
|
| - 1,6
|
|
| |
|
| - 13,8
|
|
|
|
| - 3,6
|
|
| |
|
| - 7,5
|
|
|
|
| - 5,7
|
|
| |
|
| - 6,7
|
|
|
|
| - 10,1
|
|
| |
|
| - 6,0
|
|
|
|
| - 9,2
|
|
| |
|
| - 20,5
|
|
|
|
| - 8,5
|
|
| |
|
| - 25,4
|
|
|
|
| -18,5
|
|
| |
|
| - 28,5
|
|
|
|
| - 4,6
|
|
|
В задачах (522-536) для данной гомогенной реакции А + В Û С +D определите температуру, при которой наступает равновесие. Температурной зависимостью D r H 0 и D r S 0 можно пренебречь. Рассчитайте равновесный состав системы при этой температуре, если известны начальные концентрации исходных веществ C0 (продукты реакции в начальный момент времени отсутствуют).
| №
п/п
| Уравнение реакции
| С 0, моль/л
| | А
| В
| |
| CO (г) + Cl 2 (г) = COCl2 (г)
|
|
| |
| CO (г) + ½ O 2 (г) = CO 2 (г)
|
| 0,5
| |
| NO (г) + ½ O 2 (г) = NO 2 (г)
|
| 0,5
| |
| CH 4 (г) + CO 2 (г) = 2 CO (г) + 2 H 2 (г)
|
|
| |
| CCl4 (г) + H2O (г) = COCl 2(г) +2 HCl (г)
|
|
| |
| CO (г) + 2 H 2(г) = CH 3 OH (г)
| 0,5
|
| |
| SO 2 (г) + Cl 2(г) = SO 2 Cl 2(г)
| 0,5
| 0,5
| |
| C 2 H 2(г) + N 2(г) = 2 HCN(г)
|
|
| |
| C 2 H 6(г) = C 2 H 4 (г) + H 2(г)
|
| -
| |
| CO (г) + NO (г) = CO 2 (г) + ½ N 2 (г)
| 0,5
| 0,5
| |
| CH 4(г) + CH3Cl(г) = C2 H6(г) + HCl(г)
|
|
| |
| PCl 5(г) = PCl 3(г) + Cl 2(г)
| 0,5
| -
| |
| CO 2 (г) + H 2 (г) = HCOOH (г)
| 0,2
| 0,2
| |
| CF2Cl 2 (г) = C 2 F 4 (г) + 2 Cl 2 (г)
|
| -
| |
| 2 CH 4 (г) = C 2 H 2 (г) + H 2 (г)
| 0,5
| -
|
В задачах (537-556), используя уравнение температурной зависимости константы равновесия 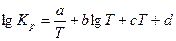 , рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре. , рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре.
| №
п/п
| Реакция
| T 2, K
| a
| b
| c
| d
| |
| 2H2 + CO «CH3OH
|
|
| -9,13
| 30,8
·10-4
| 3,401
| |
| 4HCl + O2 «2H2O + 2Cl2
|
|
| -2,13
| -8,57
·10-4
| -4,710
| |
| b-NH4Cl(к) «NH3(г) + HCl(г)
|
| -9650
| 1,83
| -32,4
·10-4
| 28,239
| |
| 2N2 + 6H2O «4NH3 + 3O2
|
| -66250
| -1,75
|
| -10,206
| |
| 4NO + 6H2O «4NH3 + 5O2
|
| -47500
| -1,75
|
| -13,706
| |
| 2NO2 «2NO + O2
|
| -5749
| 1,75
| -5,0
·10-4
| 7,899
| |
| N2O4 «2NO2
|
| -2692
| 1,75
| -4,8
·10-4
| 1,944
| |
| Mg(OH)2 «MgO + O2
|
| -4600
| 0,623
| -10,0
·10-4
| 17,776
| |
| CaCO2 «CaO + CO2
|
| -9680
| -1,38
| -2,19 ·10-4
| 17,756
| |
| Ca(OH)2 «CaO +CO2
|
| -5650
| 0,67
| 4,14 ·10-4
| 9,616
| |
| S2 + 4H2O «2SO2 + 4H2
|
| -13800
| -0,88
| 26,7 ·10-4
| 8,386
| |
| S2 + 4CO2 «2SO2 + 4CO
|
| -23000
| 4,34
| -16,2 ·10-4
| 2,576
| |
| 2SO2 + O2 «2SO3
|
|
| 1,222
|
| -18,806
| |
| SO2 + Cl2 «SO2Cl2
|
|
| -1,75
| 4,55 ·10-4
| -7,206
| |
| CO + 3H2 «CH4 + H2O
|
|
| -7,14
| 18,8 ·10-4
| -1,371
| |
| 4CO + 2SO2 «S2 + 4CO2
|
|
| -4,34
|
| -2,576
| |
| COCl2 «CO + Cl2
|
|
| 1,75
|
| 3,748
| |
| CO2 + H2 «CO + H2O
|
| -2203
|
| -0,52 ·10-4
| 2,300
| |
| CO2 + 4H2 «CH4 + 2H2O
|
|
| -6,23
| 9,06 ·10-4
| -1,291
| |
| 2CO2 «2CO +O2
|
|
| 1,75
| -12,15 ·10-4
| 3,290
|
В задачах (557-580) определите, при какой температуре в системе устанавливается химическое равновесие, укажите, используя уравнение изобары химической реакции, в каком направлении протекает реакция при температуре, отличающейся от равновесной в большую или меньшую сторону
| № п/п
| Уравнение реакции
| |
| CH4 (г) + CO2 (г) ó CH3COOH (ж)
| |
| 2H2 (г) + CO2 (г)óHCOH (ж) + H2O (ж)
| |
| CO2 (г) + H2 (г) ó HCOOH (ж)
| |
| 2SO2 (г) + O2 (г) ó 2SO3 (г)
| |
| CO (г) + 2H2 (г) ó CH3OH (г)
| |
| Ca(OH)2 (к) ó CaO (к) + H2O (г)
| |
| CaCO3 (к) ó CaO (к) + CO2 (г)
| |
| NH4Cl (к) ó NH3 (г) + HCl (г)
| |
| H2 (г) + Cl2 (г) ó 2HCl (г)
| |
| O2 (г) ó 2O (г)
| |
| CO2 (г) + H2 (г) ó CO (г) +H2O (г)
| |
| 2CO (г) + O2 (г) ó 2CO2 (г)
| |
| 2H2 (г) + O2 (г) ó 2H2O (г)
| |
| N2 (г) ó 2N (г)
| |
| 2NO (г) ó N2 (г) + O2 (г)
| |
| CH4 (г) + H2O (г) ó CO (г) + 3H2 (г)
| |
| CH4 (г) + CO2 (г) ó 2CO (г) + 2H2 (г)
| |
| 2CH4 (г) ó C2H2 (г) + 3H2 (г)
| |
| F2 (г) ó 2F(г)
| |
| Cl2 (г) ó 2Cl (г)
| |
| HCl (г) ó H (г) + Cl (г)
| |
| HF (г) ó H (г) + F (г)
| |
| 2HCl (г) + F2 (г) ó 2HF (г) + Cl2 (г)
| |
| C2H6 (г) ó C2H2 (г) + 2H2 (г)
|
|



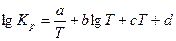 , рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре.
, рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре.


