
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел «Химическая термодинамика»Содержание книги Поиск на нашем сайте
Пример1. Определите стандартный тепловой эффект реакции NH3(г) + HCl(г) = NH4Cl(к) при: а) изобарном ее проведении - ∆r H 0298; б) изохорном ее проведении - ∆r U 0298. Решение. Стандартный тепловой эффект реакции изобарного процесса в соответствии с законом Гесса определяется по уравнению: ∆ r H 0298 = ∆ f H 0298(NH4Cl) - ∆ f H 0298 (NH3) - ∆ f H 0298 (HCl), где ∆ f H 0298 – стандартная энтальпия образования компонента, приведенная в приложении 1. Подставим данные и получим: ∆ r H 0298 = (-315,39) – (-46,19) – (-92,30) = - 176,90 кДж; реакция экзотермическая, т.к. ∆ r H 0298 < 0. Стандартный тепловой эффект изохорного процесса ∆ r U0298 можно вычислить через стандартный тепловой эффект изобарного процесса по уравнению: ∆ r U 0298 = ∆ r H 0298 – ∆n · RT, где ∆n - изменение количества моль газов в реакции. Для данной реакции ∆n = - n(NH3)- n(HCl) = -1 –1 = -2. Подставим данные и получим: ∆ r U 0298 = - 176,90.103 – (-2).8,314.298 = - 171944,86 Дж @ -172 кДж
Пример 2. Рассчитайте значение стандартной энтальпии реакции образования хлорида сурьмы (III) из простых веществ по следующим термохимическим уравнениям: 1. Sb(к) + 5/2 Cl2 (г) = SbCl5 (ж) ΔH 0 298, 1 = - 440 кДж 2. SbCl3 (к) + Cl2 (г) = SbCl5 (ж) ΔH 0 298, 2 = - 57 кДж Решение. Уравнение образования SbCl3 из простых веществ: Sb(к) + 3/2 Cl2 (г) = SbCl3 (к) (3) можно получить, если из уравнения (1) вычесть уравнение (2) Sb(к) + 5/2 Cl2 (г) -SbCl3 (к) - Cl2 (г) = SbCl5 (ж) - SbCl5 (ж) или Sb(к) + 3/2 Cl2 (г) = SbCl3 (к), откуда следует, что ΔH 3 = ΔH1- ΔH 2= (- 440) - (- 57) = - 383 кДж или стандартная энтальпия образования 1 моль хлорида сурьмы (III) равна ΔH 0298 = - 383 кДж/моль
Пример 3. Рассчитайте энтропию 1моль кремния в растворе меди, в котором его массовая доля w с оставляет 1,2%, полагая, что раствор является идеальным Решение. Энтропия 1 моль i–ого компонента в растворе определяется по уравнению: S i¢ = S i0 – Rln x i (1), где Si¢ - энтропия компонента в смеси, Si0 - энтропия чистого компонента, xi – молярная доля компонента, равная для двухкомпонентного раствора отношению количества моль растворенного вещества n1 к сумме количества моль растворенного вещества n1 и растворителя n2: xi = w = xi = Подставим в уравнение (5) данные и найдем численное значение x1 x1 = Энтропия 1 моль кремния равна S 0 =18,33 Дж/(моль.К), в растворе энтропия 1 моль кремния станет равной S¢=18,33-8,314· ln 0,0267=48,45 Дж/(моль.К).
Пример 4. Для гетерогенной реакции NH3 (г) + HCl (г) = NH4Cl(к) рассчитайте стандартное изменение энергии Гиббса D r G T 0 и константу равновесия K0 при температуре T=700K. Укажите, в каком направлении протекает реакция при данной температуре и направление смещения равновесия при увеличении температуры. При обосновании направления смещения равновесия используйте уравнение изобары химической реакции. Решение. Стандартное изменение энергии Гиббса D r G T 0 может быть вычислено по уравнению: D r G T0 = ∆ r H 0298 - T ∆ r S 0298(1), где ∆ r H 0298 - изменение энтальпии реакции (тепловой эффект реакции) при стандартных условиях, ∆ r S 0298 – изменение энтропии реакции при стандартных условиях. Расчет ∆ r H 0298 для данной реакции приведен в примере 2, согласно которому ∆ r H 0298= - 176,9 кДж. ∆ r S 0298 рассчитаем по уравнению: ∆ r S 0298 =S0(NH4Cl) – S0(NH3)- S0(HCl). Подставляя термодинамические данные из Приложения 1, получим ∆ r S 0298 = 94,56 - 192,5 – 186,7 = - 284,64 Дж/К. Стандартное изменение энергии Гиббса Dr G Т0 при T=700K равно: DrG Т0 = - 176,9 – 700.(- 284,64).10-3 = - 92,1 кДж. Так как DrG Т0 < 0, то реакция самопроизвольно протекает в прямом направлении. Для расчета константы равновесия используем уравнение: D rG Т0 = - RTlnK0 (2), откуда K0 = exp ( - Так как константа равновесия K0>> 1, реакция при T=700K протекает в прямом направлении практически необратимо. Для обоснования направления смещения равновесия при изменении температуры используем уравнение изобары химической реакции: Пример 5. Для газофазной реакции А + В = D + F рассчитайте константу равновесия при температуре Т = 700 К и равновесные концентрации веществ в системе, если известно, что стандартное изменение энергии Гиббса реакции при этой температуре равно D r G 0 = - 8 кДж и начальные концентрации равны: С 0,А = 2 моль/л, С 0,В = 3 моль/л. Концентрации веществ D и F в начальный момент равны нулю. Решение. Стандартная константа равновесия K 0 связана со стандартной энергией Гиббса реакции по уравнению: D r G 0 = - RT ln K 0. Отсюда находим логарифм стандартной константы равновесия:
Следовательно, K 0 = e 1,375 = 3,96. Стандартная константа равновесия выражается через относительные равновесные парциальные давления участников реакции, возведенных в степени, равные стехиометрическим коэффициентам. В данном случае:
P 0 – стандартное давление. Так как нам надо рассчитать равновесные концентрации, то расчет необходимо вести через константу равновесия K C, выраженную через равновесные концентрации участников реакции. В данном случае она равна: где Dn - изменение числа молей газообразных участников реакции. Для данной реакции Dn = n D + n F – n A- nB= 1 + 1 – 1 – 1 = 0. Следовательно, константы равновесия равны K 0 = K C. Теперь проведем расчет равновесных концентраций участников реакции. Предположим, что к моменту равновесия прореагировало x моль /л вещества А, тогда из уравнения реакции следует, что в реакцию вступило x моль /л вещества В и образовалось x моль /л вещества D и x моль /л вещества F. Выражаем через x равновесные концентрации веществ:
Подставим равновесные концентрации в выражение для константы равновесия K C и получим: Решаем это уравнение относительно x. Оно преобразуется к следующему квадратному уравнению: 2,96 x 2 – 19,80 x + 23,76 = 0. По известным формулам для квадратного уравнения находим, что это уравнение имеет два корня: x 1 = 5,12 и x 2 = 1, 57. Корень x 1 не удовлетворяет условию задачи, так как начальные количества исходных веществ меньше. Условию задачи удовлетворяет корень x 2 = 1, 57. Следовательно, равновесные концентрации веществ равны: [A] = 2 – 1,57 = 0,43 моль/л; [B] = 3 – 1,57 = 1,43 моль/л; [D] = [F] = 1, 57 моль/л.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 3265; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |

 (2). По условию n1 =1, а n2 определим из массовой доли w, равной
(2). По условию n1 =1, а n2 определим из массовой доли w, равной (3), где m1 и m2 – масса растворенного вещества и растворителя, а M1 и M2 – их молекулярные массы. Из уравнения (3) выразим n2: n2 =
(3), где m1 и m2 – масса растворенного вещества и растворителя, а M1 и M2 – их молекулярные массы. Из уравнения (3) выразим n2: n2 =  (4) и, подставив в уравнение (2), получим выражение для молярной доли x1:
(4) и, подставив в уравнение (2), получим выражение для молярной доли x1: (5).
(5).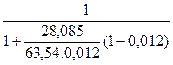 =0,0267.
=0,0267. ) = exp (-
) = exp (-  ) = exp(15,82) и K0 =7,46.106.
) = exp(15,82) и K0 =7,46.106. (3). Так как рассматриваемая реакция является экзотермической (∆rH0298 < 0), то правая часть уравнения
(3). Так как рассматриваемая реакция является экзотермической (∆rH0298 < 0), то правая часть уравнения  < 0 и с увеличением температуры Т, которая всегда положительна, уменьшается, откуда следует, что и производная
< 0 и с увеличением температуры Т, которая всегда положительна, уменьшается, откуда следует, что и производная  , приобретшая отрицательное значение, с увеличением температуры Т уменьшается, а значит, уменьшается величина константы равновесия К0. Уменьшение константы равновесия означает смещение равновесия реакции влево в сторону образования продуктов реакции, т.к. константа равновесия представляет собой отношение произведения равновесных парциальных давлений продуктов реакции к произведению равновесных парциальных давлений исходных веществ:
, приобретшая отрицательное значение, с увеличением температуры Т уменьшается, а значит, уменьшается величина константы равновесия К0. Уменьшение константы равновесия означает смещение равновесия реакции влево в сторону образования продуктов реакции, т.к. константа равновесия представляет собой отношение произведения равновесных парциальных давлений продуктов реакции к произведению равновесных парциальных давлений исходных веществ:  (4). Для данной реакции
(4). Для данной реакции 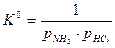 (парциальное давление твердого вещества NH4Cl(к) незначительно, от давления мало зависит и может быть внесено в константу равновесия) и ее уменьшение означает увеличение знаменателя, т.е. смещение равновесия влево в сторону исходных веществ.
(парциальное давление твердого вещества NH4Cl(к) незначительно, от давления мало зависит и может быть внесено в константу равновесия) и ее уменьшение означает увеличение знаменателя, т.е. смещение равновесия влево в сторону исходных веществ.

 где
где  - относительное равновесное парциальное давление i – го компонента, P i - его равновесное парциальное давление,
- относительное равновесное парциальное давление i – го компонента, P i - его равновесное парциальное давление, где квадратными скобками обозначены равновесные концентрации соответствующих веществ. Константы равновесия K 0 и K C связаны между собой следующим соотношением:
где квадратными скобками обозначены равновесные концентрации соответствующих веществ. Константы равновесия K 0 и K C связаны между собой следующим соотношением: 




