Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел «Химическая кинетика»Содержание книги Поиск на нашем сайте
Пример 1. Определите время, за которое прореагирует 90 % вещества А, разлагающегося по реакции первого порядка: A ® B + D, если известно, что время полупревращения составляет t ½ = 40 мин. Решение. Текущая концентрация исходного вещества для реакции 1 – го порядка определяется уравнением: C = C0 exp (-kt) (1) Количество распавшегося вещества А к моменту времени t равно x = C0 - C
Подставим в уравнение (1) С = С 0 - x и получим
Доля распавшегося вещества a равна Из этого уравнения выразим экспоненту: Логарифмируем это выражение и находим время:
Константу скорости реакции находим из уравнения для периода полупревращения реакции первого порядка: Подставляем выражение для k в уравнение для времени t и получаем окончательное уравнение:
Пример 2. Для элементарной реакции A + B = D + F при начальных концентрациях реагентов С А 0 = С В 0 = 0,6 моль/л через 20 мин. после начала реакции концентрация вещества А уменьшилась до значения С А 1 = 0,4 моль/л. Определите концентрацию вещества А через 60 мин. после начала реакции. Решение. Поскольку данная реакция элементарная, то это реакция второго порядка. При равных начальных концентрациях реагентов для реакции второго порядка решение дифференциального уравнения
приводит к следующему результату: Выразим из этого уравнения константу скорости и текущую концентрацию
Вычислим константу скорости по заданным условиям:
Далее вычисляем концентрацию вещества А через 60 мин. после начала реакции: Пример 3. Скорость образования NО в реакции: NOBr(г) ® NO(г) +1/2 Br2 (г) равна 1,6×10 -4 моль/(л×с). Определите скорость реакции, скорость расходования NOBr и скорость образования Br2 . Решение. Из уравнения следует, что из 1 моль NOBr2 образуется 1 моль NO и 1/2 моль Br2, тогда скорость реакции можно выразить через изменение концентрации любого компонента:
Скорость расходования NOBr равна скорости образования NO с обратным знаком, а скорость образования Br2 в 2 раза меньше скорости образования NO:
Пример 4. В реакции А + В ® D начальные концентрации веществ А и В равны соответственно 2,0 моль/л и 3,0 моль/л. Скорость реакции равна r =1,2× 10-3 моль/(л.с) при [ А ] =1,5 моль/л. Рассчитайте константу скорости и скорость реакции при [ В ] = 1,5 моль/л. Решение. Согласно закону действующих масс скорость реакции равна: r = k[А][В]. К моменту времени, когда [А] = 1,5 моль/л, прореагировало по 0,5 моль/л веществ А и В, поэтому [В] = 3 - 0,5 = 2,5 моль/л. Константа скорости равна: k = r / ([А][В]) =1,2×10-3 /(1,5×2,5) =3,2×10-4 л / (моль с). К моменту времени, когда [В] = 1,5 моль/л, прореагировало по 1,5 моль/л веществ А и В, поэтому [А] = 2 – 1,5 = 0.5 моль/л. Скорость реакции равна: r = k [ А ] [ В ] = 3,2 ×10-4 × 0,5× 1,5 =2,4×10-4 моль/(л.с).
Пример 5. Энергия активации первой реакции Е1 в 3 раза больше энергии активации второй реакции Е2. При нагревании от температуры Т1 = 400К до Т2 =500К константа скорости первой реакции увеличилась в 7 раз. Во сколько раз увеличилась константа скорости второй реакции при нагревании в этом же температурном интервале? Решение. Е1 / Е2 =3. Из уравнения Аррениуса k = k0 e - E/RT для первой реакции для двух различных температур справедливо соотношение ln k2 / k1 = Из этого соотношения можно выразить Аналогично из уравнения Аррениуса для второй реакции
ln k 21 / k 11 = По условию задачи Е2 = Е1 /3 и, следовательно
ln
Приложение 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2094; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.70.108 (0.008 с.) |





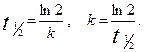


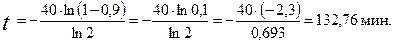




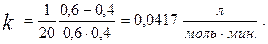
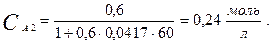

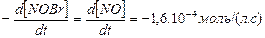 ,
, 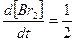
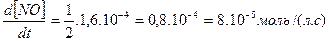

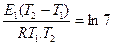


 .
.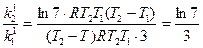 ; 3 ln
; 3 ln 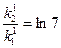 и
и