
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення глюкози в біологічних рідинахСодержание книги
Поиск на нашем сайте
глюкозооксидазним(уніфікованим) методом Мета: Опанувати кількісний колориметричний глюкозооксидазнийметод визначення глюкози в сироватці крові та за отриманими результатами зробити клініко-діагностичний висновок (стор. 110). Принцип методу: Глюкоза у присутності ферменту – глюкозооксидази окиснюється киснем повітря до глюконової кислоти:
CH2OН–(CHOН)4–СНО+О2+Н2О→CH2OН–(CHOН)4–СООН+Н2О2. глюкоза глюконова кислота
Перекис водню окиснює хромоген, перетворюючи його в забарвлену у синій колір сполуку. Реакція проводиться у термостаті при температурі 37 0С протягом 15 хвилин, потім зупиняється введенням у розчин сульфатної кислоти. Сульфатна кислота перетворює жовте забарвлення у червоне. Стабільність забарвленого комплексу зберігається протягом 1 години. Прилади та матеріали: колориметр фотоелектричний концентраційний КФК–2, піпетки градуйовані на 5 мл, 1 мл, 0,1 мл, штатив для пробірок та піпеток, досліджувана сироватка крові. Робота проводиться з використанням готового набору реактивів. Реактиви: склад набору: суха суміш реактивів (1 флакон), розчин пероксидази в стабілізаторі (1 амп.), розчин хромогену (1 амп.), розчин з масовою часткою цинк сульфату 10 % (10 мл), барій гідроксид (1 г), спиртовий розчин з масовою часткою фенолфталеїну1 % (1 мл), стандартний розчин глюкози 10 ммоль/л (1 амп.); розчин з масовою часткою сульфатної кислоти 15 % (не комплектується).
Готування робочих розчинів 1. Ензимний розчин. У хімічний стакан влити 50 мл фізіологічного розчину, кількісно додати вміст флакону сухої суміші реактивів, додати розчин хромогену, розчин пероксидази, перемішати до повного розчинення кристалів. Відфільтрувати через вату. Зберігати в холодильнику до 10 днів. 2. Розчин з масовою часткою сульфатної кислоти Н2SO4 15 % готується у лабораторії. 3. Стандартний розчин глюкози (з молярною концентрацією глюкози 10 ммоль/л) готовий до роботи. 4. Фізіологічний розчин – розчин з масовою часткою натрій хлориду NaCl 0,9 %. Хід визначення Приготувати розчин сироватки у фізіологічному розчині: у хімічну пробірку внести 1 мл фізіологічного розчину, додати 0,05 мл сироватки, перемішати. Подальший аналіз здійснюють за таблицею 18.
Таблиця 18 Склад робочих розчинів та хід визначення
Перемішують і через 5 хвилин вимірюють екстинкцію за допомогою колориметру фотоелектричного концентраційного КФК–2 у кюветах із товщиною шару 5 мм за довжини хвилі 540 нм (зелений світлофільтр). Робота з приладом описана у розділі 2.1.1. Розрахунок концентрації глюкози у сироватці крові виконують за формулою:
де
Норма глюкози в крові: 2,77 – 5,55 ммоль/л. Примітка: якщо концентрація глюкози в крові виявиться 15 ммоль/л, пробу необхідно розвести фізіологічним розчином у 2 рази, провести дослідження і результат помножити на 2. Лабораторна робота № 19 Кількісне визначення глюкози в сечі за кольоровою реакцією з о-толуїдиновим реактивом Мета: Опанувати метод кількісного визначення глюкози в сечі та за отриманими даними зробити клініко-діагностичний висновок (стор. 110). Принцип методу: Глюкоза при нагріванні з о-толуїдиновим реактивом у розчині оцтової кислоти дає зелене забарвлення, інтенсивність якого пропорційна концентрації глюкози. Прилади та матеріали: колориметр фотоелектричний концентраційний КФК-2МП, піпетки градуйовані на 2 мл, 1 мл, 0,1 мл, штатив для пробірок та піпеток, досліджувана сеча, калібратор глюкози (27,75 ммоль/л), о-толуїдиновий реактив (склад: о-толуїдин – 6 г, тіосечовина – 0,15 г, оцтова кислота – до 100 мл). Хід визначення Спочатку проводять якісну пробу на наявність глюкози (див. лабораторну роботу № 17 – реакція Тромера). У випадку позитивної якісної проби на глюкозу, перед проведенням досліду сечу розводять фізіологічним розчином в 2 – 10 разів. Ступінь розведення вказує викладач. Аналіз проводять відповідно до таблиці 19.
Всі приготовані розчини нагрівають на киплячій водяній бані 8 хвилин. Охолоджують під водопровідною водою. Фотометрують калібрувальну та досліджувані пробипроти холостої проби за довжини хвилі 590 – 650 нм у кюветі товщиною 5 мм (розд. 2.1.2). Результат множать на ступінь розведення.
Розрахунок кількості глюкози в сечі виконують за де Таблиця 19 Вміст робочих розчинів
Норма глюкози в сечі: не більше 1,11 ммоль/л.
Примітки: 1. При низькому вмісті глюкози готують калібрувальні розчини глюкози з концентраціями 5,55 ммоль/л і 16,65 ммоль/л. Для цього наявний у наборі калібратор розводять відповідною кількістю дистильованої води. 2. Наявність білка в сечі на кількісне визначення глюкози не впливає.
Лабораторна робота № 20
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.3.72 (0.009 с.) |

 ,
,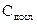 – концентрація глюкози у сироватці крові (ммоль/л); Сст. – концентрація глюкози у стандартному розчині (10 ммоль/л);
– концентрація глюкози у сироватці крові (ммоль/л); Сст. – концентрація глюкози у стандартному розчині (10 ммоль/л); 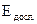 – екстинкція досліджуваної проби;
– екстинкція досліджуваної проби;  – екстинкція стандартної проби.
– екстинкція стандартної проби.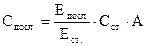 ,
,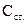 – концентрація глюкози в калібрувальному розчині (27,75 ммоль/л).
– концентрація глюкози в калібрувальному розчині (27,75 ммоль/л).


