Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Динамика изменений показателей ифа-тестовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
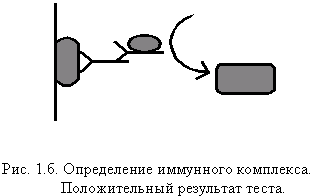
Механизм ИФА В настоящее время можно получить антитела против любых интересующих нас показателей, например, гормонов, лекарственных препаратов в крови, окомаркеров, наркотиков, а не только против инфекционных агентов. Методами ИФА возможно определение иммуноглобулинов (видовая принадлежность, субклассы, специфичность), а также идентификация лимфоцитов (субпопуляций). В настоящее время практическому здравоохранению стал доступен тИФА благодаря своей невысокой стоимости и экологической безопасности, что привело к тому, что данный метод лабораторного исследования перешёл в разряд стандартных, «рутинных» анализов. Общие принципы метода тИФА Определение антител Рассмотрим принцип определения специфических Ab методом тИФА, суть которого не зависит от биологического материала, в котором проводят анализ. На рис. 1а показана общая схема метода, состоящего из трех стадий. Во время каждой стадии в систему добавляется очередной компонент, инкубируется некоторое время, необходимое для образования иммунного комплекса. Затем ячейка промывается для удаления не связавшихся компонентов. После этого переходят к следующей стадии реакции. Рассмотрим подробнее процесс образования иммунного комплекса, который представлен на рис. 1а.
На второй стадии анализа в лунку вносят Ab с заранее прикрепленным к ним ферментом, способные связаться с Ab человека, закрепившимися на инфекционном агенте. Это так называемый конъюгат. Если в ячейке имеются образовавшиеся на первой стадии процесса иммунные комплексы, то возникает “молекулярная цепочка”, на конце которой находится фермент.
То есть, если все элементы цепочки присутствуют, в лунке образуется окрашенный комплекс (рис. 16). Если на первой стадии анализа иммунных комплексов не образовалось (рис. 1в), то отсутствует и вся последующая часть “молекулярной цепочки”, вследствие чего хромоген не окрашивает раствор. В нашем случае ключевым элементом является специфическое Ab из сыворотки крови больного к инфекционному агенту. По сути, мы анализируем способность некоторых из Ab в исследуемом материале, связаться с интересующим нас Ag.
В лабораторной диагностике и иммунологии такую способность принято характеризовать двумя параметрами: афинность и авидность. Аффинность (lat. affinitas: родственность) — термодинамическая характеристика, количественно описывающая силу взаимодействия антигена и антитела в растворе. Авидность антител — характеристика общей стабильности комплекса Ag и At. Авидность определяется аффинностью At к Ag, количеством антигенсвязывающих центров в молекуле антитела и особенностями пространственной структуры антигена, создающими препятствия для создания комплекса. Авидность описывает силу кооперативных аффинных взаимодействий. Так, например, авидность IgM может быть высокой даже при низкой аффинности отдельных антиген-связывающих центров, так как молекула IgM имеет десять таких центров, в то время как IgG может иметь два высокоаффинных центра. Помните специфичность, о которой мы говорили на первой лекции? С точки зрения химии и термодинамики специфичность рецепторов очень близка к понятиям «афинность» и «авидность». Нужно понимать, что рецепторы, участвующие в осуществлении процессов врожденного иммунитета ничуть не менее авидны к распознаваемым чужеродным молекулам, чем ВкР и ТкР лимфоцитов. Есть сведения, что все как раз наоборот: константа диссоциации рецепторов и их лигандов в системе врожденного иммунитета составляет 10-9 – 10-11, а адаптивного – 10-4 – 10-11. Таким образом, понятия «специфический» и «неспецифический» иммунитет отражают не силы связывания, а уникальность рецепторов. Во врожденном иммунитете рецепторы исходно имеют структуру, позволяющие распознавать универсальные паттерны, а ВкР и ТкР уникальны и формируются в результате встречи с антигеном.
Положительный результат теста показывает только наличие в исследуемом образце (обычно сыворотке крови больного) Ab, способных связываться с поверхностными Ag, сорбированными на твердой фазе. Результат анализа может существенно зависеть от свойств самой тест-системы и от особенностей иммунного ответа больного. Тест-системы на основе моноклональных-Ab позволяют достигать более высокой чувствительности и избирательности. Однако чрезмерно узкая избирательность может приводить к ложноотрицательным результатам при некоторых особенностях иммунного ответа организма больного. Многое зависит от того, какого рода Ag используется для сорбции на твердой фазе. Важна и степень очистки, и количество различных Ag, доступных для образования иммунных комплексов, и многое другое. Разумеется, все сказанное относится к полностью пригодным для использования тест-системам и безошибочному проведению процесса анализа Определение антигенов Для обнаружения самих инфекционных агентов, а точнее — их Ag, применяется другая модификация метода тИФА, которая представлена на рис. 2а. В этом случае на поверхности планшета (твердой фазе) сорбируются Ab к искомому агенту. Образующаяся в ходе анализа цепочка выглядит так: Ab, инфекционный агент, а далее, как и в предыдущем случае, следует комплекс Ab-F. То есть, если в исследуемом образце присутствует искомый Ag, то образуется иммунный комплекс. В ячейке присутствует фермент, который способен расщеплять хромоген с образованием окрашенного продукта (рис. 26). Это возможно только при наличии полной цепочки. Если в исследуемом образце искомый Ag (обведен на рис. 2а) отсутствует, то цепочка не образуется, и окрашивания не происходит (рис. 2в).
Ключевым элементом, от которого зависит, сформируется цепочка или нет, является искомый агент, точнее, его Ag, способные связываться с соответствующими Ab диагностической тест-системы. Все эти особенности необходимо учитывать при анализе результатов, получаемых с помощью ИФА. Только понимание того, что именно на самом деле определяет тест, позволяет правильно трактовать результат. Кроме того, необходимо учитывать динамику изменений этих показателей. Они, в общем, адекватно отражают течение инфекционного процесса, но не всегда синхронны с ним и не во всех деталях совпадают.
При инфицировании В связи с тем, что различные тест-системы дают возможность получить информацию о различных сторонах взаимодействия инфекционного агента и организма человека, возникает вопрос: каким образом значения отдельных показателей связаны с развитием исследуемых процессов. Всегда ли справедлива простая логика — чем ниже показатель, тем лучше? На рис. 3 схематически показана возможная динамика различных показателей при развитии острого инфекционного процесса. Предположим, что инфекция быстро развивается и заканчивается полным уничтожением инфекционного агента, что отражено на рис. За. Кривая 1 соответствует изменению числа бактерий, кривая 2 — уровню поверхностных Ag, определяемых методом ИФА. На рисунке видно, что эти кривые не совпадают во времени. Увеличение уровня поверхностных Ag может существенно отставать от роста числа бактерий. Некоторое запаздывание этой кривой может объясняться и тем, что чувствительность методов не бесконечно высокая, и ограниченной доступностью инфекционного агента в исследуемом материале, и рядом других причин. Возможно, сказывается то, что тест-системы, как правило, лучше реагируют на «антигенноактивные» фрагменты, в то время как Ag непосредственно на поверхности живой клетки могут оставаться недоступными для тест-системы. Даже при адекватном заборе материала для лабораторного исследования с соблюдением всех предосторожностей, как правило, отмечается подобного рода несовпадение. Таким образом, далеко не всегда результат лабораторного теста по определению поверхностного Ag инфекционного агента полностью соответствует содержанию биологически активного инфекционного материала. Результат теста зависит от многих составляющих инфекционного процесса и от конкретной реализации тест-систем. Имеют значение технология получения диагностических Ag и некоторые другие факторы, в том числе описанные выше. Еще более неоднозначной может быть трактовка результатов теста на наличие Ab к антигенам инфекционного патогена. Часто результаты такого теста могут, в общем, достаточно хорошо описываться известной кривой иммунного ответа на иммунизацию чужеродными Ag (рис.Зб). На рисунке кривая 1 отражает содержание инфекционного агента, кривая 2 — результаты вышеописанных тестов
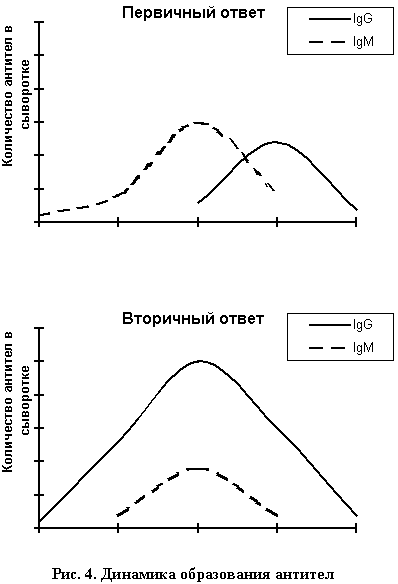
Отметим две особенности этих кривых. Во-первых, кривая 2, которая, по сути, является кривой иммунного ответа, запаздывает по отношению к кривой, отражающей содержание инфекционного агента. Иногда это бывает очень существенно. Во-вторых, уровень специфичных иммуноглобулинов (Ig), который собственно и определяется в нашем тесте, может сохраняться высоким и после подавления инфекции. Хотя это и не является абсолютным правилом. Кроме того, при анализе результатов такого теста необходимо помнить о том, какого класса Ig определялись в применявшемся тесте, поскольку при развитии иммунного ответа происходит закономерная смена классов Ig. В типичных случаях Ig класса М (первичный иммунный ответ) сменяются на Ig класса G (вторичный иммунный ответ). Вместе с тем, при реактивации хронической инфекции, “серологический профиль” пациента может имитировать первичный иммунный ответ (рис. 4).
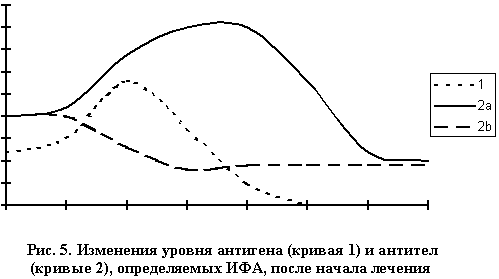
Из всего вышесказанного для практики важно следующее. Тесты, определяющие непосредственно уровень Ag в исследуемом материале, более адекватно отражают уровень содержания инфекционного патогена или другого агента, однако результаты анализа сильно зависят от выбора материала для исследования, условий его забора и др. Причем невозможность забора необходимого материала может поставить под вопрос и применимость теста вообще. Особенно важно, что во многих случаях при исследовании наиболее доступного биологического материала, которым является сыворотка крови - такие тесты закономерно дают отрицательные результаты. Вторая группа тестов, достоинство которых заключено в возможности определения инфекции или опухоли вне зависимости от локализации патологического процесса, основана на выявлении Ab различного класса, а также их классов к антигенам инфекционного агента, раковой клетки, гормона и т.п. В клиническом понимании эта информация дает сведения о стадии иммунного ответа. При лечении Рассмотрим возможные варианты результатов определения Ag и Ab методом тИФА на примере успешного лечения бактериальной инфекции (рис. 5). Начало графика соответствует началу лечения. На рисунке видно, что через некоторое время содержание поверхностных антигенов начинает увеличиваться, иногда значительно. Затем уровень медленно падает до низких значений. Показатели тестов, определяющих содержание Ig, вообще не имеют на начальном этапе лечения четких тенденций. Может наблюдаться как снижение, так и увеличение уровня. Область, в которой могут лежать возможные значения, на рисунке заштрихована. В различных случаях может наблюдаться как увеличение значений, так и их снижение. Причем это зависит не только от применявшегося препарата, но и от других факторов. Хотя можно отметить, что при использовании некоторых препаратов имеется тенденция к снижению данного показателя, в то время как при назначении других – нет.
Необходимо подчеркнуть, что в указанном случае речь идет только об изменении отдельных показателей, полученных определенным методом. Изменение содержания Ag инфекционного агента в исследуемом материале не обязательно коррелирует, а часто — вовсе не совпадает с содержанием патогена в организме пациента. Уровень специфических Ab к Ag инфекционного агента не отражает состояние общего иммунного статуса, и тем более динамику изменения концентрации специфических Аb нельзя рассматривать в качестве показателя эффективности терапии, т.е. элиминации или сохранения в организме инфекционного агента.
Helicobacter pylori Helicobacter рylori – спиральная бактерия, адаптировавшаяся к условиям существования в слизистой желудка. Ревматоидный фактор Определение РФ в периферической крови человека методом ИФА используется для обследования пациентов с подозрением на ревматоидный артрит для мониторинга и контроля эффективности проводимых лечебных мероприятий. Установлено, что высокий уровень РФ коррелирует с более тяжелым течением ревматоидного артрита и наличием системных (внесуставных) проявлений.
ЦИК Циркулирующие иммунные комплексы образуются при каждой встрече антител с антигеном и разрушаются мононуклеарными фагоцитами после активации комплемента. При избытке вирусного антигена они образуют с антителами иммунные комплексы, которые оседают в почках или в кровеносных сосудах других органов и вызывают там воспалительные реакции, чреватые повреждением тканей (например, системные заболевания, гломерулонефрит, васкулит и др). При длительной инфекции или при аутоиммунном заболевании персистенция антигена может приводить к болезни иммунных комплексов. При недостаточности комплемента происходит образование крупных, слабо растворимых комплексов с отложением их в тканях. Положительно заряженные антигены обладают способностью связываться с тканями, особенно с почечными клубочками, и способствовать локальному накоплению комплексов в почках. Увеличению отложения иммунных комплексов в тканях способствуют факторы, повышающие проницаемость кровеносных сосудов. В крови комплексы не только связаны с эритроцитами, но присутствуют также в свободной форме в плазме. Связанные с эритроцитами комплексы реже оказывают повреждающее действие, поэтому больший интерес представляет определение уровня свободных ЦИК. Для определения уровня ЦИК чаще всего применяют метод селективной преципитации полиэтиленгликолем. При данном исследовании сыворотку пациента добавляют в пробирку с полиэтиленгликолем (опыт) и боратным буфером (контроль). После инкубации при помощи спектрофотометра определяют оптическую плотность контрольного раствора и «обнуляют» показатели прибора. Затем определяют оптическую плотность опытной пробирки. Полученную величину умножают на 100, что и является величиной ЦИК, выраженной в единицах оптической плотности. Циркулирующие комплексы определяют также по их сродству к компонентам С1g и С3d комплемента, используя находящийся на твердой фазе С1g и С3d. Снижение показателей наблюдается при нарушении синтеза белков системы комплемента.Уровень ЦИК повышен при системных заболеваниях, аутоиммунных заболеваниях, васкулитах, аллергических заболеваниях. При анализе результатов, полученных в процессе определения как ЦИК, так и иммуноглобулинов, следует учитывать, что клиническое значение имеют только кратное (в 2, 3 раза и более) повышение их содержания.
АСК Стрептокиназа – это фермент гемолитического стрептококка группы А. Стрептокиназа активирует плазмин – ключевой фермент фибринолитической системы (разрушает фибриновые сгустки). Стрептокиназа - это белок с антигенными свойствами, поэтому возможна ее нейтрализация в организме соответствующими антителами. Таким образом, антистрептокиназа, активность которой мы определяем в тесте, является иммунным ферментом. В состав диагностического набора, кроме стрептокиназы, входит также тромбин, который дает в плазме образование сгустка. В присутствии стрептокиназы сгусток лизируется. Если в плазме достаточно антистрептокиназы, то она нейтрализует стрептокиназу, что проявляется наличием сгустка. Для исследования используется цитратная плазма, которую вносят в одинаковом количестве в шесть пробирок, как и тромбин. Последняя пробирка является контрольной и содержит только тромбин и плазму, и в ней всегда должен присутствовать сгусток. В остальные пробирки вносят стрептокиназу таким образом, что ее концентрация увеличивается:
*Активность АСК выражают в единицах антистрептокиназы (АЕ). Уровень активности устанавливают по содержащей сгусток пробирке, предшествующей той, в которой произошел его лизис. В норме в плазме содержится до 100 АЕ, более высокий уровень свидетельствует о возможном заболевании стрептококковой природы. Механизм ИФА В настоящее время можно получить антитела против любых интересующих нас показателей, например, гормонов, лекарственных препаратов в крови, окомаркеров, наркотиков, а не только против инфекционных агентов. Методами ИФА возможно определение иммуноглобулинов (видовая принадлежность, субклассы, специфичность), а также идентификация лимфоцитов (субпопуляций). В настоящее время практическому здравоохранению стал доступен тИФА благодаря своей невысокой стоимости и экологической безопасности, что привело к тому, что данный метод лабораторного исследования перешёл в разряд стандартных, «рутинных» анализов. Общие принципы метода тИФА Определение антител Рассмотрим принцип определения специфических Ab методом тИФА, суть которого не зависит от биологического материала, в котором проводят анализ. На рис. 1а показана общая схема метода, состоящего из трех стадий. Во время каждой стадии в систему добавляется очередной компонент, инкубируется некоторое время, необходимое для образования иммунного комплекса. Затем ячейка промывается для удаления не связавшихся компонентов. После этого переходят к следующей стадии реакции. Рассмотрим подробнее процесс образования иммунного комплекса, который представлен на рис. 1а.
На второй стадии анализа в лунку вносят Ab с заранее прикрепленным к ним ферментом, способные связаться с Ab человека, закрепившимися на инфекционном агенте. Это так называемый конъюгат. Если в ячейке имеются образовавшиеся на первой стадии процесса иммунные комплексы, то возникает “молекулярная цепочка”, на конце которой находится фермент. То есть, если все элементы цепочки присутствуют, в лунке образуется окрашенный комплекс (рис. 16). Если на первой стадии анализа иммунных комплексов не образовалось (рис. 1в), то отсутствует и вся последующая часть “молекулярной цепочки”, вследствие чего хромоген не окрашивает раствор. В нашем случае ключевым элементом является специфическое Ab из сыворотки крови больного к инфекционному агенту. По сути, мы анализируем способность некоторых из Ab в исследуемом материале, связаться с интересующим нас Ag.
В лабораторной диагностике и иммунологии такую способность принято характеризовать двумя параметрами: афинность и авидность. Аффинность (lat. affinitas: родственность) — термодинамическая характеристика, количественно описывающая силу взаимодействия антигена и антитела в растворе. Авидность антител — характеристика общей стабильности комплекса Ag и At. Авидность определяется аффинностью At к Ag, количеством антигенсвязывающих центров в молекуле антитела и особенностями пространственной структуры антигена, создающими препятствия для создания комплекса. Авидность описывает силу кооперативных аффинных взаимодействий. Так, например, авидность IgM может быть высокой даже при низкой аффинности отдельных антиген-связывающих центров, так как молекула IgM имеет десять таких центров, в то время как IgG может иметь два высокоаффинных центра. Помните специфичность, о которой мы говорили на первой лекции? С точки зрения химии и термодинамики специфичность рецепторов очень близка к понятиям «афинность» и «авидность». Нужно понимать, что рецепторы, участвующие в осуществлении процессов врожденного иммунитета ничуть не менее авидны к распознаваемым чужеродным молекулам, чем ВкР и ТкР лимфоцитов. Есть сведения, что все как раз наоборот: константа диссоциации рецепторов и их лигандов в системе врожденного иммунитета составляет 10-9 – 10-11, а адаптивного – 10-4 – 10-11. Таким образом, понятия «специфический» и «неспецифический» иммунитет отражают не силы связывания, а уникальность рецепторов. Во врожденном иммунитете рецепторы исходно имеют структуру, позволяющие распознавать универсальные паттерны, а ВкР и ТкР уникальны и формируются в результате встречи с антигеном. Положительный результат теста показывает только наличие в исследуемом образце (обычно сыворотке крови больного) Ab, способных связываться с поверхностными Ag, сорбированными на твердой фазе. Результат анализа может существенно зависеть от свойств самой тест-системы и от особенностей иммунного ответа больного. Тест-системы на основе моноклональных-Ab позволяют достигать более высокой чувствительности и избирательности. Однако чрезмерно узкая избирательность может приводить к ложноотрицательным результатам при некоторых особенностях иммунного ответа организма больного. Многое зависит от того, какого рода Ag используется для сорбции на твердой фазе. Важна и степень очистки, и количество различных Ag, доступных для образования иммунных комплексов, и многое другое. Разумеется, все сказанное относится к полностью пригодным для использования тест-системам и безошибочному проведению процесса анализа Определение антигенов Для обнаружения самих инфекционных агентов, а точнее — их Ag, применяется другая модификация метода тИФА, которая представлена на рис. 2а. В этом случае на поверхности планшета (твердой фазе) сорбируются Ab к искомому агенту. Образующаяся в ходе анализа цепочка выглядит так: Ab, инфекционный агент, а далее, как и в предыдущем случае, следует комплекс Ab-F. То есть, если в исследуемом образце присутствует искомый Ag, то образуется иммунный комплекс. В ячейке присутствует фермент, который способен расщеплять хромоген с образованием окрашенного продукта (рис. 26). Это возможно только при наличии полной цепочки. Если в исследуемом образце искомый Ag (обведен на рис. 2а) отсутствует, то цепочка не образуется, и окрашивания не происходит (рис. 2в).
Ключевым элементом, от которого зависит, сформируется цепочка или нет, является искомый агент, точнее, его Ag, способные связываться с соответствующими Ab диагностической тест-системы. Все эти особенности необходимо учитывать при анализе результатов, получаемых с помощью ИФА. Только понимание того, что именно на самом деле определяет тест, позволяет правильно трактовать результат. Кроме того, необходимо учитывать динамику изменений этих показателей. Они, в общем, адекватно отражают течение инфекционного процесса, но не всегда синхронны с ним и не во всех деталях совпадают. Динамика изменений показателей ИФА-тестов При инфицировании В связи с тем, что различные тест-системы дают возможность получить информацию о различных сторонах взаимодействия инфекционного агента и организма человека, возникает вопрос: каким образом значения отдельных показателей связаны с развитием исследуемых процессов. Всегда ли справедлива простая логика — чем ниже показатель, тем лучше? На рис. 3 схематически показана возможная динамика различных показателей при развитии острого инфекционного процесса. Предположим, что инфекция быстро развивается и заканчивается полным уничтожением инфекционного агента, что отражено на рис. За. Кривая 1 соответствует изменению числа бактерий, кривая 2 — уровню поверхностных Ag, определяемых методом ИФА. На рисунке видно, что эти кривые не совпадают во времени. Увеличение уровня поверхностных Ag может существенно отставать от роста числа бактерий. Некоторое запаздывание этой кривой может объясняться и тем, что чувствительность методов не бесконечно высокая, и ограниченной доступностью инфекционного агента в исследуемом материале, и рядом других причин. Возможно, сказывается то, что тест-системы, как правило, лучше реагируют на «антигенноактивные» фрагменты, в то время как Ag непосредственно на поверхности живой клетки могут оставаться недоступными для тест-системы. Даже при адекватном заборе материала для лабораторного исследования с соблюдением всех предосторожностей, как правило, отмечается подобного рода несовпадение. Таким образом, далеко не всегда результат лабораторного теста по определению поверхностного Ag инфекционного агента полностью соответствует содержанию биологически активного инфекционного материала. Результат теста зависит от многих составляющих инфекционного процесса и от конкретной реализации тест-систем. Имеют значение технология получения диагностических Ag и некоторые другие факторы, в том числе описанные выше. Еще более неоднозначной может быть трактовка результатов теста на наличие Ab к антигенам инфекционного патогена. Часто результаты такого теста могут, в общем, достаточно хорошо описываться известной кривой иммунного ответа на иммунизацию чужеродными Ag (рис.Зб). На рисунке кривая 1 отражает содержание инфекционного агента, кривая 2 — результаты вышеописанных тестов
Отметим две особенности этих кривых. Во-первых, кривая 2, которая, по сути, является кривой иммунного ответа, запаздывает по отношению к кривой, отражающей содержание инфекционного агента. Иногда это бывает очень существенно. Во-вторых, уровень специфичных иммуноглобулинов (Ig), который собственно и определяется в нашем тесте, может сохраняться высоким и после подавления инфекции. Хотя это и не является абсолютным правилом. Кроме того, при анализе результатов такого теста необходимо помнить о том, какого класса Ig определялись в применявшемся тесте, поскольку при развитии иммунного ответа происходит закономерная смена классов Ig. В типичных случаях Ig класса М (первичный иммунный ответ) сменяются на Ig класса G (вторичный иммунный ответ). Вместе с тем, при реактивации хронической инфекции, “серологический профиль” пациента может имитировать первичный иммунный ответ (рис. 4).
Из всего вышесказанного для практики важно следующее. Тесты, определяющие непосредственно уровень Ag в исследуемом материале, более адекватно отражают уровень содержания инфекционного патогена или другого агента, однако результаты анализа сильно зависят от выбора материала для исследования, условий его забора и др. Причем невозможность забора необходимого материала может поставить под вопрос и применимость теста вообще. Особенно важно, что во многих случаях при исследовании наиболее доступного биологического материала, которым является сыворотка крови - такие тесты закономерно дают отрицательные результаты. Вторая группа тестов, достоинство которых заключено в возможности определения инфекции или опухоли вне зависимости от локализации патологического процесса, основана на выявлении Ab различного класса, а также их классов к антигенам инфекционного агента, раковой клетки, гормона и т.п. В клиническом понимании эта информация дает сведения о стадии иммунного ответа. При лечении Рассмотрим возможные варианты результатов определения Ag и Ab методом тИФА на примере успешного лечения бактериальной инфекции (рис. 5). Начало графика соответствует началу лечения. На рисунке видно, что через некоторое время содержание поверхностных антигенов начинает увеличиваться, иногда значительно. Затем уровень медленно падает до низких значений. Показатели тестов, определяющих содержание Ig, вообще не имеют на начальном этапе лечения четких тенденций. Может наблюдаться как снижение, так и увеличение уровня. Область, в которой могут лежать возможные значения, на рисунке заштрихована. В различных случаях может наблюдаться как увеличение значений, так и их снижение. Причем это зависит не только от применявшегося препарата, но и от других факторов. Хотя можно отметить, что при использовании некоторых препаратов имеется тенденция к снижению данного показателя, в то время как при назначении других – нет.
Необходимо подчеркнуть, что в указанном случае речь идет только об изменении отдельных показателей, полученных определенным методом. Изменение содержания Ag инфекционного агента в исследуемом материале не обязательно коррелирует, а часто — вовсе не совпадает с содержанием патогена в организме пациента. Уровень специфических Ab к Ag инфекционного агента не отражает состояние общего иммунного статуса, и тем более динамику изменения концентрации специфических Аb нельзя рассматривать в качестве показателя эффективности терапии, т.е. элиминации или сохранения в организме инфекционного агента.
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 429; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.141.38 (0.021 с.) |