
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методи об’ємного аналізу їх учасники та застосування в тхк.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Тема: Консультація на тему: " Об’емний аналіз "
Мета: Допомогти студентам – заочникам більш глибоко вивчити тему об’емний аналіз, вміння розв’язувати задачі.
Виховна мета: Розвивати абстрактне мислення.
I.Організаційна частина. II. Вивчення нового матеріалу. 1. Титрування. 2. Одиниці виміру концентрації розчинів. 3. Еталон в об’емному аналізі. 4. Метод (як робиться).
III. Закріплення:
IV. Рішення задач. 1) Приливання одного розчину до другого із мірної посуди бюретки. 2) а) % концентрації (кількість грамів речовини в 100 г. розчину). б) Молярна (См) (кількість молей розчинної речовини в 1 л. Розчину). M в 1 л. = См х М (формула маси речовини в 1 л. Розчину через молярну концентрацію). в) Нормальна (Сп) (кількість грамів – еквівалентів розчинної речовини в 1 л. розчину). Евівалент – це та кількість речовини, яка вступае в реакцію (з 1 вагою частиною водню або 8 ваговими частинами кисню.) Всі речовини вступають в реакцію лише в еквівалентних кількостях.
М в 1 л. = Сп х Е Т – титр – кількість грамів речовини містить в 1 мл. розчину.
М в любому об’емі В якості еталону в об’емному аналізі використовуються розчини які називаються: Стандартний 2. Титрований це одне і те саме Робочий Це розчини, концентрація (Сп) яких відома і як правило виражена нормальністю. HCl + NaOH = NaCl + H2O HCl – 1л. 1н. розчину містить 36,5г. NaOH – 1л. н. розчину містить – 40г. Коли об’еми рівні, то і нормальності однакові, а якщо об’еми різні, то і нормальності зворотно пропорціональні. За V і Сп одного розчину судимо про Сп другого розчину, який вступив з першимв реакцію.
Ця залежність між V та Сп реагуючихи речовин ввійшла в науку під назвою закону пропорціональності. Звідси: Сп досліджуваного Залежність міжV I Сп існує тільке для нормальної концентроції. Стандартні розчини готують двома способами: 1. Із фіксаналів; 2. по вірно розрахованій наважці, взятій на аналітичних терезах. Наприклад: потрібно приготувати 750 мл. 0,14 н. розчину щавелевої кислоти. Використовуемо формулу Як робиться? (метод) Титрування (метод нейтралізації). Наприклад: В об’ємному аналізі 3 учасники: 1.досліджуванний розчин; 2.стандартний розчин; Індикатор (необхідний для установлення точки еквівалентності). Об’ємний аналіз ділиться на слідуючі методи: Нейтралізації Осадження Комплексонометрії Перманганатометрії Йодометрії. Закріплення. 1. Чому концентрація стандартного розчину завжди виражена нормальністю? 2. Ви взяли 10 мл. досліджуваного розчину,відтитрували його 10 мл. стандартного розчину, що ви можете сказати про нормальність аналізуемого розчину? (концентрація однакова), а якщо 10 мл. досліджуваного розчину відтитрували 20 мл. стандартного?
Задачі: Ю.Н. Жванко та інші. стор. 94 приклад 1. стор. 95 контрольне запитання № 8,№ 7,№ 9 Задача: 6 г. NaOH розчинили в 1 л. розчину, яка нормальність одержаного розчину? Задача: 6 г. NaOH розчинили в 750 мл. розчину, визначте Сп? Задача: Розрахувати титр 0,05 н. HCl Сп HCl = 0.05
Запитання для самоконтролю
1. Що таке обємний аналіз? Які речовини належать до встановлюючих речовин, та яким вимогам вони повинні відповідати?
2. В якому агрегатному стані досліджуються речовини об’ємним аналізом
3. Які методи об’ємного аналізу ми вивчаємо?
4. Скільки учасників в об’ємному аналізі? Які?
5. |Які концентрації найчастіше використовуються в об’ємному аналізі?
6. Чим зумовлюються: а). нормальна концентрація; б). титр -?
7. Якими способами готуються стандартні розчини?
8. Як розрахувати наважку для приготування розчину заданої концентрації?
9. Як визначаються еквіваленти: а). кислоти; б). основи; в). солі; г).окислювача та відновника. Наведіть приклади.
10. В чому суть методу нейтралізації? Яка хімічна реакція лежить в основі цього методу?
11. Які індикатори використовують в методі нейтралізації?
12. Як розрахувати вміст кислоти або лугу в розчині?
13. Зробіть розрахунки для приготування 250,0 мл. 0,1розчину лугу NaOH. (Відповідь: наважка NaOH = 1 г).
14. Розрахуйте титр 0,1096 н. розчину НСI. (Відповідь ТНСI = 0,0040 г/мл.).
15. Скільки грамів щавелевої кислоти містилось в розчині об’ємом250,0мл. якщо на титрування 10,0 мл. його витрачено 12,50 мл. 0,15 н. розчину NaOH? (Відповідь: m щ. к. = 2,9531 г.)
16. Яка особливість методів оксидиметрії? Які це методи?
17. Як змінюється ступінь окислення мангану в перманганаті калію, якщо окислення розчином KMnO4 проводити в кислому, нейтральному та лужному середовищі?.
18. Чому не можна приготувати стандартний розчин KMnO4 прямо з розрахованої наважки.
19. Т KMnO4 = 0,005816 г/мл.. Знайти нормальність розчину для реакції, в якій перманганат перетворюється на MnSO4 (Відповідь:Cn KMnO4 = 0,1835н.)
20. Які реакції лежать в основі методу йодометрії?
21. На чому оснований метод осадження?
22. Що таке аргентометрія?
23. В чому сутність способу Мору?
24. Де та з якою метою ми використовуємо аргентометрію? 25. В якому середовищі необхідно визначити кількість NaCI?
26. Скільки грамів NaCI міститься в розчині об’ємом 500,0 мл., якщо на титрування 20,0 мл. його витрачається 25,0 мл. 0,05 н р-ну AgNO3? (Відповідь: m NaCI =1,8281).
27. На титрування розчину кухонної солі необхідно 30,20мл розчину AgNO3 (Т AgNO3=0,1245 г/мл.). Визначити масу хлориду натрію (NaCI) в даному розчині. (Відповідь: m NaCI = 1,2928 г.)
28. В чому суть методу комплексонометрії?
29. Яку сполуку в комплексонометрії позначають через ЕДТА?
30. Що ми визначаємо методом комплексонометрії?
31. Чим зумовлюється загальна жорсткість води? В яких одиницях вона вимірюється?
32. Чому дорівнює загальна жорсткість води, якщо на титрування 100,0 мл. її витрачено 25,20 мл. 0,1022 н розчину ЕДТА? (Відповідь: загальна жорсткість води дорівнює 25,7544 мг-екв./л.
Тести
1. На чому базується об’ємний метод аналізу? а). зважування на терезах; б). титрування; в). осадження.
2. Який спосіб вираження концентрації розчинів найчастіше використовується в об’ємному аналізі. а). % б). молярна в). нормальна
3. Який спосіб вираження концентрації розчинів використовується в об’ємному аналізі? а). %; б) титр; в). молярна;
4. Скільки учасників в об’ємному аналізі для,безбарвних розчинів? а). 4; б). 2; в). 3;
5. Скільки учасників в об’ємному аналізі для забарвлених розчинів? а). 4; б). 2; в). 3;
6. В якому методі об’ємного аналізу використовують два стандартних розчини – для визначення окислювачів, та визначення відновників? а). перманганатометрії; б). комплексонометрії;
в). йодометрії
7. Чим визначається титр?
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 486; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.70 (0.009 с.) |

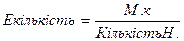 ;
; 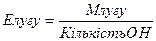 ;
; 
 ; Тстанд./аналіз
; Тстанд./аналіз 
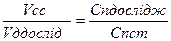 ;
;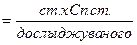 - це математичний вираз закону пропорціональності.
- це математичний вираз закону пропорціональності.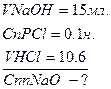

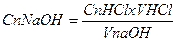 ;
;


