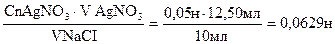Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Розрахунки в об’ємному аналізі.Содержание книги Поиск на нашем сайте
Під час об’ємно - аналітичних визначень найчастіше розраховують одну з 3 –х величин: V – об’єм стандартного розчину, витраченого на титрування досліджуваної речовини (мл.), Сn – концентрацію досліджуваного розчину та вміст досліджуваної речовини в розчині в грамах. Для цього використовують слідуючу формулу:
Cn
Для визначення нормальної концентрації, або об’єму розчину можна використати формули – математичне вираження закону еквівалентів – нормальні концентрації реагуючих розчинів знаходяться в зворотно пропорціональній залежності до їх об’ємів:
Якщо відомо три величини з цих чотирьох, то можна визначити любу невідому речовину:
Масу розчиненої речовини можна визначити за титром, якщо відомий об’єм: m=T·V, а виходячи з цієї формули можна визначити титр або об’єм, якщо відома маса:
Якщо, за умовою задачі, відома нормальна концентрація, то титр можна розрахувати за іншою формулою: Т=
Іноді, за умовою задачі, необхідно визначити титр однієї речовини за іншою, тоді використовують таку формулу: ТnaCI/AgNO3=
А тепер для прикладу розберемо декілька задач.
Задача 1. Приготувати 500,0мл. 0,1 н розчину щавелевої кислоти – Н2С2О4 х 2Н2О.
Дано: Сn щ.к. = 0,1 н. М (Н2С2О4 х 2Н2О) = 126 г.
m щ.к.-? m щ.к.=
Відповідь: для того, щоб приготувати 500 мл 0,1 розчину щавелевої кислоти необхідно відважити на аналітичних терезах, перенести в мірну колбу на 500,0 мл., додати невелику кількість дистильованої води, добре перемішати до повного розчинення щавелевої кислоти і долити до мітки дистильовану воду.
Задача 2. Хімічно чистий карбонат кальцію масою 1,3250 г. розчинили в колбі на 250,0 мл. дистильованою водою. 25,0 мл. цього розчину відтитрували 26,47 мл. розчину трилону Б. Визначити нормальну концентрацію розчину трилону Б.
mCaCO3 = 1,3250 г Для визначення нормальної концентрації трилону Б VCaCO3 = 250,0 мл. використаємо формулу - математичне вираження закону V1CaCO3 = 25,0 мл. еквівалентів:
Cn Тр. Б -? Але нам за умовою задачі дається маса карбонату кальцію, а не його нормальна концентрація. Тому перш за все визначимо Сn СаСО3 за формулою: Сn СаСО3 = М(СаСО3) = 100 г. Екв.(СаСО3) = Сn СаСО3=
А тепер, знаючи Сn СаСО3 можна визначити Сn Тр.Б.
Сn Тр.Б =
Відповідь: нормальна концентрація трилону Б в цій реакції дорівнює 0,1 н.
Задача 3. Визначити об’єм 0,05 н розчину хлоридної кислоти, який необхідно для взаємодії з 20 мл. 0,1 н розчину КОН.
Cn HCℓ = 0,05 н Сn КОН = 0,1 н
VHCℓ -? взаємодії з 20 мл. 0,1 н. розчину КОН дорівнює 40 мл.
Задача 4. Титр розчину хлоридної кислоти дорівнює 0,03647 г/мл. Чому дорівнює його титр за гідроксидом калію – КОН?
Для того, щоб визначити ТНСℓ/КОН необхідно знайти Т НСℓ/КОН -? Cn HCℓ та Екв. KOH.
ТHCℓ = Cn HCℓ =
М(НСℓ) = 36,5 г.
Екв.(НСℓ)=
Cn HCℓ = М(КОН) = 56 г.
Екв.(КОН)
Т НСI/КОН =
Відповідь: ТНСℓ/КОН = 0,0559 г/мл.
Задача 5. На титрування розчину, приготовленого розчиненням 0,1020 г NaCℓ, необхідно 38,40 мл встановлюваного розчину AgNO3. Визначити: а). нормальну концентрацію розчину AgNO3 та б).Т AgNO3/Сℓ.
Дано: Це найскладніший тип задач, де дається маса однієї
V АgNO3 =38,40 мл. іншої. Перш за все треба пам’ятати, що речовини
Сn АgNO3-? тобто однокавою кількістю г- еквівалентів. Т АgNO3 /Сℓ -?. Якщо ми знайдемо, яку кількість г-еквівалент складає 0,1020 г NaCℓ, то така ж сама кількість г-екв.AgNO3 вступить з нею в реакцію. Для цього розрахуємо вартість 1 г-екв. NaCℓ. М (NaCℓ) = 58,5 г
Екв. NaCℓ = Знаходимо кількість г-екв. NaCI 0,1020 г: 58,5 = 0,0017 така ж сама кількість г-екв. вступить в реакцію АgNO3. Тепер легко визначити масу АgNO3, якщо знайдемо вартість г-екв. його та помножимо на кількість г-екв. М (АgNO3) = 170 г х Екв. АgNO3 = m АgNO3 =170 х 0,0017 = 0,296 (г) з формули маси переходимо до формули нормальної концентрації
Сn АgNO3 = ТАgNO3/СI= Екв.Сℓ= 35,5 г
Відповідь: Нрмальна концентрація АgNO3 в даній реакції дорівнює 0,045 н, а Т АgNO3/СI=0,0016 г/мл.
Задача 6. На титрування 0,2173 г соди Na2CO3 витрачено 23,17 мл. розчину хлоридної кислоти. Визначити Сn HCI та ТHCI/ Na2CO3.
реагуючих речовин. Тому в першу чергу необхідно m соди = 0,2173 г визначити кількість г-екв. соди, що вступають в реакцію
вартість одного г-екв. соди. СnНСℓ-? М (Na2CO3) = 106 г. ТНСℓ/Na2CO3-? + M – молярна маса 106г
n– загальна валентність металу 2
Знаходимо кількість г-екв. соди 0,2173 г: 53 = 0,0041. Така ж сама кількість г-екв. хлоридної кислоти вступає в реакцію з содою. Розрахувавши вартість одного г-екв. хлоридної кислоти, знайдемо масу її. М(НСℓ) = 36,5 г . Екв.НСℓ= mHCI= 36,5 х 0,0041 = 0,1496 (г)
CnHCI=
ТНСℓ/Na2CO3 =
Задача 7. На титрування розчину NaOH витрачено 21,72 мл. 0,1251 н. розчину хлоридної кислоти. Обчисліть масу NaOH в розчині.
Дано: Знаходимо масу НСI
V HCI = 21,72 мл Екв.НСI = 36,5 г/моль.
mNaOH -? 0,0992: 36,5 = 0,0027. Вартість одного г-екв. NaOH = М(NaOH) = 40 г. Кількість г-екв. реагуючих речовин завжди однакова, тому помноживши вартість г-екв. NaOH на кількість г-екв-знайдемо масу NaOH
40 х 0,0027 = 0,108 (г) NaOH
Задача 8. Скільки грамів хлориду натрію містилось в 250 мл. розчину, якщо на титрування 10,0 мл. його витрачено 12,50 мл.0,05 н розчину AgNO3?
VNaCI = 250,0 мл. V1NaCI= 10,0 мл. Екв. NaCI=
mNaCI -? Сn NaCI можна знайти за формулою- математичне вираження закону еквівалентів.
Сn NaCI = А тепер можемо розрахувати масу NaCI, що міститься в 250,0 мл. даного розчину. mNaCI=
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 774; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.249.61 (0.008 с.) |

 але в деяких задачах дається маса розчиненої речовини, а потрібно визначити нормальну концентрацію досліджуваного розчину, тому з основної формули маси можна визначити концентрацію
але в деяких задачах дається маса розчиненої речовини, а потрібно визначити нормальну концентрацію досліджуваного розчину, тому з основної формули маси можна визначити концентрацію

 ; або
; або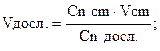






 V = щ.к. = 500,0 мл. Екв. щ. к. =
V = щ.к. = 500,0 мл. Екв. щ. к. =  ;
;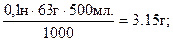
 Дано:
Дано: VТР.Б = 26,47 мл.
VТР.Б = 26,47 мл. 



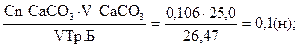
 Дано:
Дано:  , звідси
, звідси
 V КОН = 20,0 мл. Відповідь: Об’єм хлоридної кислоти, необхідний для
V КОН = 20,0 мл. Відповідь: Об’єм хлоридної кислоти, необхідний для Дано: Т НСℓ/КОН=
Дано: Т НСℓ/КОН= 

 ,звідси
,звідси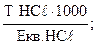
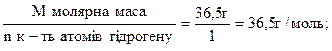



 ;
; mNaCℓ=0,1020 г речовини, а треба знайти нормальну концентрацію
mNaCℓ=0,1020 г речовини, а треба знайти нормальну концентрацію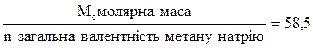 : 1=58,5 г/моль.
: 1=58,5 г/моль.
 ;
;
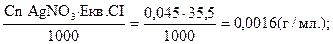
 VНСI =23,17 мл. з хлоридною кислотою. Але для цього треба розрахувати
VНСI =23,17 мл. з хлоридною кислотою. Але для цього треба розрахувати
 Екв.Na2CO3= = 53 г/моль
Екв.Na2CO3= = 53 г/моль


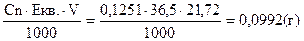
 CnHCI=0,1251н Тепер знаходимо кількість г-екв. НСI
CnHCI=0,1251н Тепер знаходимо кількість г-екв. НСI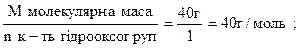


 ;
;

 V AgNO3 =12,5 мл. М(NaCI) = 58,5 г/моль
V AgNO3 =12,5 мл. М(NaCI) = 58,5 г/моль СnAgNO3 = 0,05 н Екв. NaCI =
СnAgNO3 = 0,05 н Екв. NaCI =  = 58,5 г/моль.
= 58,5 г/моль.