
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод окислення – відновлення, який в свою чергуСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
підрозділяється на метод перманганатометрії та йодометрії; 3. Метод осадження; 4. Метод комплексонометрії.
Метод нейтралізації.
В основі методу лежить реакція взаємодії між іонами Н+ (що зумовлюють кисле середовище) та ОН- (що зумовлюють лужне середовище). Метод застосовується для визначення кислот, основ та солей, (які взаємодіють з основами або кислотами, такі як Na2CO3, NH4Cℓ, Na2B2О7 та інші.). Для визначення кислот використовують титровані розчини лугів – NaOH або КОН, для визначення основ – розчини кислот - НСℓ; H2SO4; H2C2O4; Любе об’ємно-аналітичне визначення складається з слідуючих операцій: 1. Приготування стандартного розчину; 2. Вибір індикатора; 3. Встановлення титру та нормальності стандартного розчину; 4. Титрування досліджуваного розчину стандартним розчином; 5. Розрахунки результатів аналізу. В методі нейтралізації в якості індикаторів використовують: 1. Фенолфталеїн; 2. Метиловий оранжевий; Таблиця 1.
Методи оксидиметрії. а). перманганатометрія – це метод об'ємного аналізу, в якому в якості стандартного розчину використовують розчин КМnО4. Перманганат калію являється сильним окислювачем, особливо в кислому середовищі і здатен окислювати багато речовин. Для того, щоб зрозуміти чому це так, необхідно згадати будову атому мангану та пояснити, що з ним відбувається, коли він знаходиться в складі КМnО4 в різних середовищах розчинів. Найкраще це йому вдається в кислому середовищі, він збирає найбільшу кількість електронів аж 5. Mnº +25)))) 1S22S22P63S23P64S23d5
В період хімічного збудження відбувається розпарювання 4S2 електронів, так як є вільні орбіталі Р, d, ƒ, таким чином манган має 7 неспарених електронів на 3 –ому та 4-ому рівнях, які він легко може віддати іншим елементам, відновлюючи їх, а сам окислюється до останньої межі: +7 Наприклад в сполуці КМnО4 де манган має окислювальне число +7. Схаменувшись, що віддав всі свої неспарені електрони, манган стає сильним агресором, тобто окислювачем і намагається повернути їх собі. Наприклад: -2 +7 +2 5Н2S + 2KMnO4 + 3H2SO4→5Sº+2MnSO4+K2SO4+8H2O;
Mn + 5е- = Mn+2 2 окислювач S-2 – 2e- = S0 10 5 відновник
В нейтральному середовищі манган приєднує 3 електрони. +7 +4 +4 +6
Mn+7 + 3 е- = Mn+4 2 окислювач S+4 – 2e- = S+6 6 3 відновник
В лужному середовищі манган приєднує лише 1 електрон. +4 +7 +6 +6 Na2SO3+2KMnO4+2KOH→Na2SO4 + 2К2MnO4 + Н2О;
Це дуже важливо знати, тому що є такі задачі, в яких еквівалент KMnO4 треба визначити залежно від середовища, в якому відбувається реакція.
Наприклад:
Задача. ТKMnO4= 0,002980. Знайти нормальну концентрацію розчину для реакцій, в яких перманганат калію перетворюється: а). в МnO2; б).MnSO4;
Дано:
Знайти Сn KMnO4 в реакціях: а) перетворюється на МnO2; б).перетворюється на МnSO4; +7 +3е +4 а). KMnO4 → MnO2 +7 процес відновлення, але Mn являється окислювачем. Знаходимо молярну масу KMnO4. М (KMnO4) = 158 г. Еквівалент окислювача дорівнює молярній масі поділеній на кількість прийнятих електронів.
Екв. KMnO4 =
Так як в умові задачі дається титр, а його формула
Т =
+7 +5e- +2
В цьому випадку еквівалент перманганату буде іншим.
Екв. KMnO4 (в кислому середовищі). Cn KMnO4=
В методі перманганатометрії розчин KMnO4 виконує 2 функції - (досліджуваного або стандартного розчину та індикатору). Так як він має рожево-фіолетове забарвлення, то коли його титрують – до обезбарвлення, а коли ним титрують, то аж доки не з’явиться блідо-рожеве забарвлення досліджуваного розчину, яке не зникне на протязі 1 хвилини.
В нашому курсі ми вивчаємо дві роботи. 1. “Приготування розчину КMnO4 та визначення його Cn і Т”. 2. “Визначення заліза в солі Мора”. Хімізм методу перманганатометрії: а).для першої роботи: “Приготування стандартного розчину KMnO4 та визначення його Cn за щавелевою кислотою”. +7 -2 +2 2 KMnO4 + 5 Н2С2О4 +3Н2SO4 = 2MnSO4 + 10CO02 + K2SO4 + 8H2O
C2O2-4 – 2e- = 2CO02 10 5 відновник
б). для другої роботи: “Визначення вмісту заліза в солі Мору “. 2 KMnO4 + 10FeSO4 + 8Н2SO4 = 5Fe2(SO4)3 + 2MnSO4 + К2SO4 + 8H2O;
Mn7+ + 5e- = Mn2+ 1 окислювач
Метод йодометрії.
Йодометрія – один з методів оксидиметрії, в основі якого лежать реакції: I02 + 2е- = 2I-; 2I-I – 2е- = I02; Цим методом визначають окислювачі та відновники. При цьому використовують два стандартних розчини – для визначення відновників – розчин йоду (окислювач), для визначення окислювачів – розчин тіосульфату натрію Na2S2O3 – (відновник). Окислювачі визначають методом заміщення, суть якого в тому, що до досліджуваного розчину додають надлишок розчину КІ в кислому середовищі. Окислювач виділяє з КІ еквівалентну кількість йоду, який відтитровують розчином Na2S2O3. В якості прикладу розберемо реакцію з К2Сч2О7 (окислювач). К2Сч2О7 + 6КІ + 7Н2SO4 = 3І02 + Сч2(SO4)3 +K2SO4 + 7H2O;
2І- - 2е- = І02 3 відновник
І2 + 2Na2S2O3 = 2NaI + Na2S4O6 Тетратіонат натрію I02 + 2e- = 2I- 2S2O2-3 – 2e- = S4O3-6 тетратіонат натрію
Дихромат калію виділяє еквівалентну кількість йоду. За об’ємом розчину тіосульфату натрію, який пішов на титрування йоду, можна розрахувати нормальну концентрацію розчину К2Сч2О7, а потім його титр та масу в грамах. Вміст відновників в розчинах знаходять прямим титруванням стандартним розчином І2. Йодомитричний метод широко використовують в харчових лабораторіях для дослідження жирів на вміст ненасичених жирних кислот.
Метод осадження.
В основі методу осадження лежать реакції, що відбуваються з випадінням осаду, до якого пред’являються певні вимоги: 1. Осад повинен бути практично нерозчинним; 2. Взаємодія між стандартним розчином та досліджуваним повинна відбуватися відповідно рівнянню реакції; 3. Випадіння осаду повинно відбуватися швидко. 4. Повинна чітко визначатися точка еквівалентності. Найчастіше методом осадження визначають вміст іонів І-, Вч-; Сℓ; в вигляді срібних солей: АgI; AgBr; AgCℓ. Метод застосовують для визначення вмісту кухонної солі в окремих продуктах харчування, напівфабрикатів або росолах. Для визначення іонів І-, Вч-; Сℓ; в якості стандартного розчину використовують розчин AgNO3, тому метод називають аргентометричним. Але найчастіше використовується спосіб Мора, який нескладний в використані та має достатню точність визначення. В нашій практиці використовується для визначення кількості хлориду натрію в I та II стравах, рублених м’ясних н/ф, солоній рибі до та після вимочування.
Спосіб Мора. В якості стандартного розчину використовується 0,05 н розчин АgNO3 титр та нормальність якого встановлюють за розчином NaCℓ, індикатором являється 5% - ний розчин К2СчО4. Визначення хлориду натрію відбувається за хімізмом.
NaCℓ+AgNO3 = NaNO3 +AgCℓ↓ Білий К2СчО4 + 2AgNO3 = 2KNO3 + Ag2CrO4 ↓ Червоно-бурий.
Титрування за методом Мора необхідно проводити в нейтральному середовищі, тому що в кислому середовищі розчиняється хромат срібла, а в лужному утворюється бурий оксид срібла Ag2O, який заважає визначенню точки еквівалентності; в аміачному середовищі і хлорид і хромат срібла розчиняються з утворенням комплексного аміакату срібла.
Метод комплексонометрії Комплексонометрія – метод об’ємного аналізу, в основі якого лежить реакція утворення комплексної сполуки при взаємодії катіонів з комплексонами. В якості індикатора при титруванні комплексонами застосовують речовини (металіндикатори), які також дають комплексні сполуки з цими ж іонами металів, але менш стійкі та характерно забарвлені. Ми в своїй практиці цим методом визначаємо загальну жорсткість води, що зумовлюється в основному катіонами Сa2+ та Mg2+ у вигляді різних солей – хлоридів, сульфатів, карбонатів та інших. Для проведення багатьох технологічних процесів необхідна м’яка вода, а тому технологи повинні знати як, та вміти визначати жорсткість води. В останній час, для визначення загальної жорсткості стали використовувати комплексонометрію, так як цей метод досить чутливий, вимагає невеликих затрат часу та дає добрі результати. Для визначення загальної жорсткості води (яка складається з тимчасової та постійної), в якості стандартного розчину використовують розчин трилону Б, в якості індикатора еріохром чорний Т, ну, а в якості досліджуваного розчину – звичайна водопровідна вода. Реакція найкраще відбувається в лужному середовищі, при рН =10, тому таке середовище підтримується аміачним буферним розчином, який додають до води при її титрувані. Якщо умовно позначити еріохром чорний через Н2Э, а комплексон через Na2H2X, то процес можна відобразити схематично:
Синій синій
Синій червоний
[CaЭ] + Na2H2Х = Νa2[CaХ- ]+Э2+ + 2Н+ червоний безбарвний безбарвний синій
В точці еквівалентності відбувається перехід забарвлення з червоного в синьо-голубий. Шляхом титрування визначається об’єм стандартного розчину трилону Б, який пішов на взаємодію з певним об’ємом досліджуваної води і визначається загальна жорсткість досліджуваної води за формулою: Заг. ЖН2О =
В об’ємному аналізі використовуються для вимірювання об’ємів розчинів – бюретки (мірний посуд на 25 мл.), піпетки Мора (від 1 до 50 мл.), мірні колби (від 100 мл. до 1000 мл.) та мірні циліндри різних об’ємів. Стандартні розчини готують декількома способами: 1. Найпростіший і найточніший це із готових фіксаналів що являють собою скляні запаяні ампули, в яких міститься 1 г- екв. певної речовини. Якщо цю речовину перенести в мірну колбу на 1000 мл і долити дистильованою водою, то добре перемішавши одержимо 0,1 н. розчин даної речовини. 2. Другий спосіб – за точно розрахованою та відваженою на аналітичних терезах наважкою. Наважка розраховується за формулою маси в любому об’ємі
Сn – нормальна концентрація розчину; Екв. – еквівалент розчиненої речовини, V – об’єм, в якому розчиняється наважка. Наприклад: приготували 250 мл. 0,1 н. розчину NaOH
Дано:
M – молярна маса 40 г
m NaOH = Відважують 1 г NaOH переносять в мірну колбу на 250 мл., додають дистильовану воду і розчин готовий. Але не всі речовини можна приготувати таким способом і мати точну концентрацію, тому що деякі, як наприклад і NaOH адсорбують з повітря вуглекислий газ та водяні пари і утворюють на своїй поверхні карбонати. А деякі окислюють органічні рештки, що містяться навіть у дистильованій воді, і на протязі 8-10 діб зменшують свою концентрацію, наприклад розчин перманганату калію. Тому приготовані розчини відтитровують розчинами встановлюючи речовин, наприклад: щавелева кислота, розраховують точну концентрацію їх і використовують уже, як стандартні. До встановлюючи речовин ставляться певні вимоги: 1). речовина повинна бути хімічно чиста; 2). склад її повинен строго відповідати формулі;
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 458; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.217.139 (0.013 с.) |

 2 8 13 2
2 8 13 2





 1S2 2S2 2Р6 3S2 3Р6 3d5 4Р6
1S2 2S2 2Р6 3S2 3Р6 3d5 4Р6











 ТKMnO4= 0,002980.
ТKMnO4= 0,002980.
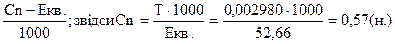
 б). KMnO4 MnSO4;
б). KMnO4 MnSO4;



 Н2Э 2Н+ + Э2-
Н2Э 2Н+ + Э2-
 Са2+ + Э2- [CaЭ]
Са2+ + Э2- [CaЭ]

 V NaOH = 250,0 мл.
V NaOH = 250,0 мл. 
 ;
;




