Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Чем больше кратность связи, тем более прочная связь в молекуле. При нулевой кратности связи молекула не образуется.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Рассмотрим некоторые случаи строения молекул по ММО. Молекула Н2 образуется из двух атомов Н, атомная валентная зона которого представлена одним электроном на 1s– подуровне. При чём необходимо, чтобы электроны имели противоположные спины. Изобразим строение молекулы Н2 на следующей энергетической диаграмме (рисунок 5). При заполнении этой диаграммы следует учитывать принципы заполнения электронных орбиталей (принцип Паули, принцип Гунда, принцип минимальной энергии).
Поскольку в первую очередь заполняются орбитали с меньшей энергией, то электроны пойдут на связывающую орбиталь. А так как по принципу Паули их там может поместиться только два, то электронов для разрыхляющей орбитали уже не остаётся. Кратность связи в этом случае будет равна n = (2-0)/2 = 1, то есть связь осуществляется одной парой электронов. Что касается молекулярного иона Н2+, то он образуется из атома Н и протона Н+, у которого нет валентного электрона (рисунок 6). Кратность связи в этом случае будет равна n = (1-0)/2 = 1/2, то есть связь осуществляется одним электроном. Такое явление МВС объяснить не может. Аналогичную структуру будет иметь и молекулярный ион Н2–, который образуется из атома Н и атомарного иона Н–, который имеет один лишний валентный электрон (два электрона идут на связывающую орбиталь, а один– на разрыхляющую). Кратность связи в этом случае будет равна n = (2-1)/2 = 1/2, то есть связь так же осуществляется одним электроном. Из всего вышесказанного следует, что более прочной будет молекула Н2 по сравнению с молекулярными ионами, поскольку она характеризуется большей кратностью связи; а сами молекулярные ионы Н2+ и Н2– по прочности абсолютно одинаковы.
С помощью ММО можно объяснить отсутствие молекул благородных газов. Рассмотрим это на примере молекулы He2, которая должна была бы образовываться из двух атомов Не с АВЗ 1s2 (рисунок 7).
В этом случае кратность связи будет равна n = (2-2)/2 = 0, то есть связь не осуществляется, поскольку нет общей электронной пары и нет выигрыша в энергии. А при таких условиях молекула не образуется. За водородом и гелием идут элементы, имеющие более сложное строение электронной оболочки, следовательно, молекулы, образуемые этими веществами, будут иметь соответствующее строение. Рассмотрим это на примере молекулы О2 (рисунок 8). Она образуется из двух атомов кислорода с АВЗ 2s22р4. Поскольку s– орбитали обладают меньше энергией, чем р–, то на энергетической диаграмме они будут располагаться ниже. Обратите ещё раз внимание на то, что валентные электроны различных атомов имеют антипараллельные спины. Поскольку каждый из атомов предоставляет по одной s- орбитали и по три р– орбитали, то общее количество молекулярных орбиталей будет равно восьми. Из двух атомных s– орбиталей образуются две молекулярные: σs– связывающая и σs– разрыхляющая (так как перекрывание электронных облаков происходит по линии, соединяющей центры атомов). Из шести р– орбиталей образуется три связывающие и три разрыхляющие орбитали. В силу того, что одна пара электронных облаков перекрывается по линии, соединяющей центры атомов, между ними образуются σр– связывающая и σр– разрыхляющая молекулярные орбитали. Между оставшимися двумя парами р– орбиталей будет наблюдаться боковое перекрывание, поэтому образуются две pр- связывающие орбитали, одинаковые по энергии, и две pр– разрыхляющие, так же одинаковые по энергии. На энергетической диаграмме σр– связывающая орбиталь расположена ниже pр– связывающих, так как при образовании σ– связи выделяется больше энергии, следовательно сама связь будет обладать меньшим запасом энергии. Заполнение диаграммы электронами (12 электронов у обоих атомов) происходит по мере увеличения энергии молекулярных орбиталей (снизу вверх). На разрыхляющих орбиталях два электрона находятся в разных ячейках, так как в этом случае суммарный спин системы будет максимальным. Кратность связи в этом случае будет равна n = (8-4)/2 = 2, то есть связь так же осуществляется двумя парами электронов.
Строение молекулярного иона О2+ или О22+ будет отличаться отсутствием одного или двух электронов соответственно на разрыхляющих орбиталях. Кратность связи при этом будет повышаться (n = (8-3) / 2 = 2,5 и n = (8-2) / 2 = 3) и прочность ионов по сравнению с прочностью молекулы О2 будет увеличиваться. То есть удаление электрона со связывающейорбитали уменьшает энергию связи в молекулярном ионе, а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой. ММО позволяет объяснить существование электронодефицитных соединения (B2H6, NO) и соединений благородных газов; магнетизм и окраску вещества; устойчивость молекулярных ионов и атомов в сравнении с молекулами.
Типы химических связей 3.3.1 Ковалентная связь – это двухцентровая двухэлектронная связь, образующаяся за счёт перекрывания электронных облаков, несущих неспаренные электроны с антипараллельными спинами. Как правило образуется между атомами одного химического элемента. Количественно она характеризуется валентностью. Валентность элемента – это его способность образовывать определенное число химических связей за счёт свободных электронов, находящихся атомной валентной зоне. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участие в связывании. Связь между атомами может осуществляться не только одной, но и двумя и даже тремя поделенными парами. Такие связи называются двойными и т ройными - кратными связями. 3.3.1.1 Ковалентная неполярная связь. Связь, осуществляемая за счет образования электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной. Она возникает между атомами с практически равной электроотрицательностью (0,4 > ΔЭО > 0) и, следовательно, равномерным распределением электронной плотности между ядрами атомов у гомоядерных молекул. Например, Н2, О2, N2, Cl2 и т. д. Дипольный момент таких связей равен нулю. Связь СН в предельных углеводородах (например, в СН4) считается практически неполярной, т.к. Δ ЭО = 2,5(С)- 2,1(Н) = 0,4. 3.3.1.2 Ковалентная полярная связь. Если молекула образована двумя разными атомами, то зона перекрывания электронных облаков (орбиталей) смещается в сторону одного из атомов, и такая связь называется полярной. При такой связи вероятность нахождения электронов возле ядра одного из атомов выше. Например, НCl, H2S, PH3. Полярная (несимметричная) ковалентная связь - связь между атомами с различной электроотрицательностью (2 > ΔЭО > 0.4) и несимметричным распределением общей электронной пары. Как правило, она образуется между двумя неметаллами. Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда d- (дельта минус), а на менее электроотрицательном атоме - частичного положительного заряда d+ (дельта плюс) Cd+- Cld-, Cd+- Od-, Cd+- Nd-, Od-- Hd+, Cd-- Mgd+. Направление смещения электронов обозначается также стрелкой: C®Cl, C®О, C®N, ОН, CMg. Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения. Поэтому, чем полярнее связь, тем она прочнее. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. Третьим свойством ковалентной связи является её направленность. 3.3.2 Ионная связь. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому, как правило, ионная связь образуется между металлом и неметаллом. Рассмотрим в качестве примера реакцию между атомами натрия (3s1) и фтора (2s23s5). Разница электроотрицательности в соединении NaF
Натрий, отдав фтору свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретает фтор, приняв один электрон, отданный натрием. В результате возникают силы электро-статического притяжения между противоположно заряженными ионами. Ионная связь – крайний случай полярной ковалентной связи, основанная на электростатическом притяжении ионов. Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов (DЭО > 2), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. В силу этого иoннaя связь не имеет пространственной направленности и насыщаемости, так как каждый ион связан с определенным числом противоионов (координационное число иона). Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Например, MgS, NaCl, А2O3. Соединений с чисто ионными связями практически не существует, поскольку всегда остаётся некоторая доля ковалентности в силу того, что полного перехода одного электрона к другому атому не наблюдается; в самых «ионных» веществах доля ионности связи не превышает 90 %. Например, в NaF поляризация связи составляет около 80 %. В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов. Валентность элементов в соединениях с ионными связями очень часто характеризуют степенью окисления, которая, в свою очередь, соответствует величине заряда иона элемента в данном соединении. Степень окисления - это условный заряд, который приобретает атом в результате перераспределения электронной плотности. Количественно она характеризуется числом смещённых электронов от менее электроотри-цательного элемента к более электроотрицательному. Положительно заряженный ион образуется из того элемента, который отдал свои электроны, а отрицательный ион - из элемента, который эти электроны принял. Элемент, находящийся в высшей степени окисления (максимально положительной), уже отдал все свои валентные электроны, находящиеся в АВЗ. А поскольку их количество определяется номером группы, в которой стоит элемент, то высшая степень окисления для большинства элементов и будет равна номеру группы. Что касается низшей степени окисления (максимально отрицательной), то она появляется при формировании восьмиэлектронной оболочки, то есть в том случае, когда АВЗ заполняется полностью. Для неметаллов она рассчитывается по формуле № группы – 8. Для металлов равна нулю, поскольку они электроны принимать не могут. Например, АВЗ серы имеет вид: 3s23р4. Если атом отдаст все электроны (шесть), то приобретёт высшую степень окисления +6, равную номеру группы VI, если примет два, необходимые для завершения устойчивой оболочки, то приобретёт низшую степень окисления –2, равную № группы – 8 = 6 – 8= –2. 3.3.3 Металлическая связь. Большинство металлов обладает рядом свойств, имеющих общий характер и отличающихся от свойств других веществ. Такими свойствами являются сравнительно высокие температуры плавления, способность к отражению света, высокая тепло– и электропроводность. Эти особенности объясняются существованием в металлах особого вида взаимодействия – металлической связи. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов, которые достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате этого в кристаллической решетке металла появляются положительно заряженные ионы, локализованные в определенных положениях кристаллической решетки, и большое количество делокализованных (свободных) электронов, сравнительно свободно перемещающихся в поле положительных центров и осуществляющих связь между всеми атомами металла за счёт электростатического притяжения. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве. Силы связи в металлах не локализованы и не направлены, а свободные электроны, образующие «электронный газ», обусловливают высокую тепло- и электропроводность. Поэтому в этом случае невозможно говорить о направленности связей, так как валентные электроны распределены по кристаллу почти равномерно. Именно этим и объясняется, например, пластичность металлов, т. е. возможность смещения ионов и атомов в любом направлении 3.3.4 Донорно-акцепторная связь. Помимо механизма образования ковалентной связи, согласно которому общая электронная пара возникает при взаимодействии двух электронов, существует также особый донорно-акцепторный механизм. Он заключается в том, что ковалентная связь образуется в результате перехода уже существующей (неподелённой) электронной пары донора (поставщика электронов) в общее пользование донора и акцептора (поставщика свободной атомной орбитали).
D + A → D A
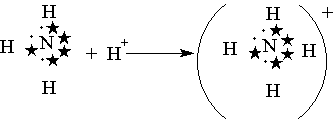
После образования она ничем не отличается от ковалентной. Донорно-акцепторный механизм хорошо иллюстрируется схемой образования иона аммония (рисунок 9) (звездочками обозначены электроны внешнего уровня атома азота):
Рисунок 9- Схема образования иона аммония
Электронная формула АВЗ атома азота 2s22р3, то есть он имеет три неспаренных электрона, которые вступают в ковалентную связь с тремя атомами водорода (1s1), каждый из которых имеет один валентный электрон. При этом образуется молекула аммиака NH3, в которой сохраняется неподелённая электронная пара азота. Если к этой молекуле подойдёт протон водорода (1s0), не имеющий электронов, то азот передаст свою пару электронов (донор) на эту атомную орбиталь водорода (акцептор), в результате чего образуется ион аммония. В нём каждый атом водорода связан с атомом азота общей электронной парой, одна из которых реализована по донорно-акцепторному механизму. Важно отметить, что связи Н—N, образованные по различным механизмам, никаких различий в свойствах не имеют. Указанное явление обусловлено тем, что в момент образования связи орбитали 2s– и 2р– электронов атома азота изменяют свою форму. В итоге возникают четыре совершенно одинаковые по форме орбитали. В качестве доноров обычно выступают атомы с большим количеством электронов, но имеющие небольшое число неспаренных электронов. Для элементов II периода такая возможность кроме атома азота имеется у кислорода (две неподеленные пары) и у фтора (три неподеленные пары). Например, ион водорода Н+ в водных растворах никогда не бывает в свободном состоянии, так как из молекул воды Н2О и иона Н+ всегда образуется ион гидроксония Н3О+ Ион гидроксония присутствует во всех водных растворах, хотя для простоты в написании сохраняется символ H+. 3.3.5 Водородная связь. Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), который «стягивает» на себя общую электронную пару, испытывает недостаток электронов и приобретает эффективный положительный заряд. Поэтому он способен взаимодействовать с неподеленной парой электронов другого электроотрицательного атома (который приобретает эффективный отрицательный заряд) этой же (внутримолекулярная связь) или другой молекулы (межмолекулярная связь). В результате возникает водородная связь, которая графически обозначается точками:
Эта связь значительно слабее других химических связей (энергия ее образования 10 – 40 кДж/моль) и в основном имеет частично электростатический, частично донорно-акцепторный характер. Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. Например, связи О—Н в Н2О имеют заметный полярный характер с избытком отрицательного заряда d– на атоме кислорода. Атом водорода, наоборот, приобретает небольшой положительный заряд d + и может взаимодействовать с неподеленными парами электронов атома кислорода соседней молекулы воды. Взаимодействие между молекулами воды оказывается достаточно сильным, таким, что даже в парах воды присутствуют димеры и тримеры состава (H2O)2, (Н2O)3 и т. д. В растворах же могут возникать длинные цепи ассоциатов такого вида:
поскольку атом кислорода имеет две неподеленные пары электронов. Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С. Типичные случаи ассоциации наблюдаются для спиртов и органических кислот. Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Например, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Н-связи влияют на физические и химические свойства вещества. Связи типа водородных не образуют атомы других элементов, поскольку силы электростатического притяжения разноименных концов диполей полярных связей (О-Н, N-H и т.п.) довольно слабы и действуют лишь на малых расстояниях. Водород, обладая наименьшим атомным радиусом, позволяет сблизиться таким диполям настолько, что силы притяжения становятся заметными. Никакой другой элемент с большим атомным радиусом не способен к образованию подобных связей. 3.3.6 Силы межмолекулярного взаимодействия (силы Ван-дер-Ваальса). В 1873 г. голландский ученый И. Ван-дер-Ваальс предположил, что существуют силы, обуславливающие притяжение между молекулами. Эти силы позднее получили название ван-дер-ваальсовых сил – наиболее универсальный вид межмолекулярной связи. Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж/∙моль. В зависимости от способа возникновения силы делятся на: 1) ориентационные (диполь-диполь или ион-диполь) - возникают между полярными молекулами или между ионами и полярными молекулами. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя (рисунок 10).
2) индукционные (диполь – индуцированный диполь или ион– индуцированный диполь) - возникают между полярными молекулами или ионами и неполярными молекулами, но способными к поляризации. Диполи могут воздействовать на неполярные молекулы, превращая их в индицированные (наведенные) диполи. (рисунок 11).
3) дисперсионные (индуцированный диполь – индуцированный диполь) - возникают между неполярными молекулами, способными к поляризации. В любой молекуле или атоме благородного газа возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается (рисунок 12).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1492; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.01 с.) |

 E
AO
E
AO
 E
AO
E
AO
 Е
AO
Е
AO

 DЭО = 4,0 - 0,93 = 3,07
DЭО = 4,0 - 0,93 = 3,07