
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение электронной оболочки атомаСодержание книги
Поиск на нашем сайте
1.2.1 Квантовые числа электрона. При химических реакциях ядро атома не претерпевает изменений. Изменению подвергается внешняя часть электронной оболочки атомов, строением которой объясняются многие свойства химических элементов. В современной модели атома состояние в нем электронов определяется четырьмя параметрами – квантовыми числами. Первые три характеризуют движение электронов в пространстве (получаются при решении уравнения Шрёдингера), а четвертое – вокруг собственной оси (вводится дополнительно). Главное квантовое числоn определяет энергию электрона в атоме и среднее удаление электрона от ядра. n принимает целочисленные значения от 1 до ∞. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами (K, L, M, N, O, P и Q) или цифрами. Буква K соответствует первому уровню, L – второму и т. д. Уровень содержит строго определенное число электронов – максимально N= 2n2, где N – число электронов; n – номер уровня (считая от ядра) или главное квантовое число. В соответствии с уравнением, на первом, ближайшем к ядру, энергетическом уровне может находится не более двух электронов, на втором – не более 8, на третьем – не более 18, на четвертом – не более 32. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. То есть, наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня, электроны последующих уровней характеризуются большим запасом энергии. Поэтому они менее прочно связаны с ядром, вследствие чего могут принимать участие в образовании химических связей. Бесконечно большое значение n говорит о том, что электрон находится на бесконечно большом расстоянии от ядра, т. е. является свободным, или не связанным с ядром. Из периодической системы для любого элемента, находящегося в невозбуждённом состоянии, по номеру периода можно определить максимальное число энергетических уровней атома (№ периода = n) и то, какой энергетический уровень является внешним. Например, элемент кадмий Cd расположен в пятом периоде, значит n = 5. В его атоме электроны распределены по пяти энергетическим уровням (n = 1, n = 2, n = 3, n = 4, n = 5); внешним будет пятый уровень (n = 5).
Начиная со значения главного квантового числа n = 2, энергетические уровни (слои) подразделяются на подуровни (подслои), отличающиеся друг от друга энергией связи с ядром и характеризующиеся орбитальным квантовым числом l. Число подуровней равно значению главного квантового числа: первый уровень имеет один подуровень, второй уровень – два, третий - три и т. д. Подуровни, в свою очередь, состоят из орбиталей. Атомная орбиталь – этообластьпространства около ядра, в котором вероятность нахождения электрона наиболее велика (≈ 95 %). То есть, энергетическим подуровнем называется совокупность электронов с одинаковым значением n и l, поскольку орбитали одного подуровня (l = const) имеют одинаковую энергию. Побочное (орбитальное или азимутальное) квантовое число l определяет энергию электрона на подуровне и форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, …, (n-1)). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа l соответствует орбиталь особой формы. При l = 0 атомная орбиталь имеет сферическую форму (s- орбиталь). Она самая устойчивая и располагается довольно близко к ядру. Значению l = 1 соответствует атомная орбиталь, имеющая форму гантели (p-орбиталь). Изменение формы объясняется тем, что чем дальше располагается электрон от ядра, чем больше возрастает его энергия в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания и наконец превращается в гантелеобразную p-орбиталь Еще более сложную форму имеют орбитали, отвечающие более высоким значениями l, равным 2, 3 и 4 (d-, f-, g-орбитали). Таким образом, каждому цифровому значению соответствует буквенное:
По цифровому значению l можно рассчитать число электронов на энергетическом подуровне: максимально N = 2(2l+1), где N – число электронов; l – номер подуровня. Магнитное квантовое число ml определяет пространственное расположение атомной орбитали в пространстве относительно внешнего магнитного или электрического поля. Принимает целочисленные значения от – l до + l, включая 0. Это означает, что для каждой формы орбитали существует (2 l + 1) энергетически равноценных ориентации в пространстве.
Для s- орбитали (l = 0) такое положение одно и соответствует ml = 0. Гантелеобразные p-орбитали могут занимать три положения (2l + 1 = 3) вдоль осей координат пространства x, y и z: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга. Орбитали d - (2l + 1 = 5) и f- (2l + 1 = 7) могут занимать пять и семь положений соответственно. Форма и ориентация s-, p- и d-орбиталей изображена на рисунке 1.
Всё вышесказанное можно обобщить с помощью таблицы 1.
Таблица 1 –Количество орбиталей и электронов на уровнях и подуровнях
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 566; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.100.99 (0.008 с.) |





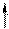 Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, соответствующие противоположным направлениям вращения. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз.
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установлено, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ±1/2, соответствующие противоположным направлениям вращения. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз.


