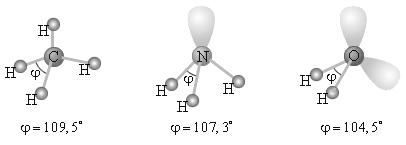Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Геометрия молекул. Гибридизация атомных орбиталейСодержание книги
Поиск на нашем сайте Гибридизация орбиталей – это выравнивание формы и энергии некоторых орбиталей при образовании ковалентной связи. Гибридные орбитали представляют собой линейную комбинацию АО и обладают определенной ориентацией в пространстве (симметрией). Таким образом, когда один атом образует несколько связей, а его валентные электроны принадлежат разным орбиталям (s и p; s, p и d), для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие: 1) гибридные орбитали обладают более высокой энергией, чем исходные атомные, зато они обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей и, соответственно, дают больший выигрыш в энергии при образовании связи; 2) число гибридных орбиталей равно числу АО, участвующих в гибридизации; 3) гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты; 4) химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Если валентная оболочка атома включает электроны на одной s-орбитали и одной p-орбитали, имеет место sp-гибридизация. Рассмотрим её на примере молекулы BeCl2.
Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2px-электрона бериллия, то связи Be-Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под углом 180° за счёт того, что одна s– орбиталь и одна p– орбиталь “смешиваются” и выравниваются по форме и энергии, давая две одинаковые sp– гибридные орбитали (рисунок 13).
Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия отталкиваются и лежат на одной прямой и благодаря этому молекула BeCl2 имеет линейную форму, а обе связи Be-Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы: HC≡CH, MgН2 и т. д.
Такую же форму будут иметь и молекулы BH3, H2C=CH2, C6H6 и т. д.
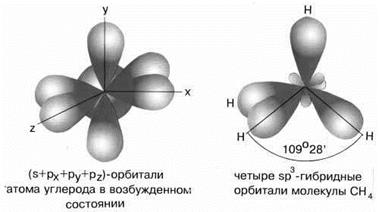
Примером может служить соединение углерода с водородом СН4 (метан). В стационарном состоянии углерод двухвалентен, а для образования связи с водородом необходимо четыре свободных электрона. Они появляются при распаривании s-электронов. В результате образуется четыре гибридных орбитали, которые расположатся максимально далеко друг от друга только тогда, когда молекула примет форму правильного тетраэдра, у которого в центре находится атом C, а в вершинах – атомы H. Углы между всеми связями равны и составляют 109°28'. Такой же тип гибридизации будет характерен для молекул CCl4, H3C–CH3. Все вышеописанные молекулы образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Однако, если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи, – несвязывающими или неподеленными электронными парами.
В качестве примера рассмотрим молекулы NH3 и H2O. Атомы азота и кислорода склонны к sp3 -гибридизации. У азота на sp3-ГО, помимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна неподелённая пара. Именно она, занимая одну sp 3-ГО, искажает угол связи H–N–H до 107,3°. В молекуле H2O таких неподелённых пар две, и угол H–O–H равен 104,5° (рисунок 16).
Объясняется это тем, что электроны связывающих и несвязывающих пар по-разному взаимодействуют между собой. Обычно считается, что несвязывающие пары занимают больший объем, чем связывающие, а объем связывающих пар тем меньше, чем больше электроотрицательность периферийных атомов, то есть неподеленные пары отталкиваются между собой несколько сильнее, чем от поделенных пар, и чем поделенные пары отталкиваются друг от друга. Поэтому реально этот тетраэдр в молекулах NH3 и H2O слегка искажен, потому что реальный угол составляет не 109о, а 107,3о и 104,5о соответственно. При образовании иона аммония NH4+ по донорно-акцепторному механизму неподелённая электронная пара азота занимает свободную атомную орбиталь протона водорода и угол в ионе увеличивается до 109°28'. Аналогичное явление наблюдается при образовании иона аксония Н3О+, но угол увеличивается до 107,3о, поскольку только одна из двух неподелённых пар находит себе свободную орбиталь. А вот в ледяной воде угол увеличивается до109°28', поскольку ещё одна неподелённая пара электронов оказывается вовлечённой в водородную связь.
3.5 Химическая связь в твердых телах. Кристаллические решетки Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними. Кристаллическая структура характеризуется правильным (регулярным) расположением частиц в строго определенных местах в кристалле. Точки, в которых размещены частицы, называются узлами кристаллической решетки. В зависимости от того, какие структуры находятся в узлах, различают следующие типы кристаллических решёток. Атомная кристаллическая решётка построена из атомов, соединенных, как правило, ковалентной связью. Поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью. Например, углерод (алмаз и графит) карборунд SiC, бор. Молекулярная кристаллическая решётка образована молекулами, между которыми осуществляется межмолекулярное взаимодействие. Поскольку силы между молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы. Например, метан СН4, диоксид углерода СО2 и т. д. Ионная кристаллическая решётка состоит из положительных и отрицательных ионов, между которыми действуют электростатические силы. Поскольку они намного превышают слабые ван-дер-ваальсовы силы, то температуры плавления ионных кристаллов выше, чем атомных и молекулярных. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 311 °C. Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ). Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
4 Вопросы и задания
1 Каковы современные представления о строении атома? Какие элементарные частицы входят в состав ядра? 2 Каков физический смысл порядкового номера элемента? Как определить число протонов, нейтронов и электронов в атоме? Как влияет изменение количества этих структурных единиц на строение атома? 3 Что называют изотопами? Почему атомные массы большинства элементов имеют дробные числа? Могут ли атомы разных элементов иметь одинаковую атомную массу? Как называются такие атомы? 4 Охарактеризуйте квантовые числа n, l, ml, ms. Какие значения они могут принимать? 5 Дайте определение энергетического уровня (слоя)? Каким квантовым числом он характеризуется? Как определяется максимально возможное число подуровней и число электронов на данном энергетическом уровне? 6 Что называют энергетическим подуровнем? Как обозначаются подуровни и из чего они состоят? Какое максимально возможное число электронов может находиться на каждом подуровне? Дайте этому объяснение. 7 Что такое атомная орбиталь (энергетическая ячейка)? Какие квантовые числа её характеризуют? Как определяется число орбиталей на энергетическом подуровне? Какую форму имеют s- p-,d- и f- орбитали? 8 Сформулируйте основные принципы заполнения электронной оболочки атома (принцип минимальной энергии, принцип Паули, принцип Гунда). 9 Какие орбитали заполняются раньше и почему: 4d или 5s; 6s или 5p? 10 Что называют электронной формулой элемента? Энергетической диаграммой? 11 Какие семейства элементов вам известны? Что называют атомной валентной зоной (АВЗ) элемента? Как определяется АВЗ для элементов различных семейств? 12 Напишите электронные формулы атомов элементов с порядковым номером 9, 28, 31, 35, 80, и 84. К какому семейству относится каждый из этих элементов? 13 Покажите распределение электронов АВЗ этих элементов по квантовым ячейкам. Определите их возможные валентные состояния? Чему равен суммарный спин р– электронов у первого элемента и сколько свободных d– орбиталей у последнего элемента? 14 Дайте современную формулировку периодического закона Д.И.Менделеева. Укажите связь периодической системы со строением атома (порядковый номер, номер периода, номер группы). В чём причина периодичности свойств? 15 Где в таблице расположены s-, p-, d- и f- семейства? Что общего у элементов одного периода? Одной группы? В чём отличие элементов главных и побочных подгрупп? 16 Что называют радиусом атома? Как он изменяется по периоду, в главных подгруппах, по периодической системе? Почему? 17 Что понимают под энергией ионизации? Энергией сродства к электрону? Электроотрицательностью? Как они изменяется по периоду, в главных подгруппах и по периодической системе в целом? Почему? 18 Как изменяются окислительно-восстановительные свойства элементов по периоду, в главных подгруппах и по периодической системе? Почему? 19 Как изменяются кислотно-основные свойства оксидов и гидроксидов (оксидгидроксидо) по периоду? В главных подгруппах? По периодической системе? Почему? 20 В чём заключается причина образования химической связи? Какие теории химической связи вы знаете? В чём суть этих теорий? 21 Нарисуйте энергетическую схему образования молекулы Н2 и молекулярного иона Н2– по методу молекулярных орбиталей. Объясните, где и почему энергия связи больше. 22 Могут ли существовать молекула Не2 и молекулярный ион Не2+? Почему? Ответ мотивируйте на основании строения молекул по ММО. 23 Нарисуйте энергетическую схему образования молекулы N2 и молекулярного иона О2+ по методу молекулярных орбиталей. Сколько электронов находится на связывающих и разрыхляющих орбиталях? Чему равен порядок связи в этих молекулах? Почему? 24 Какие типы химической связи вы знаете? Приведите примеры. 25 Какую химическую связь называют ковалентной? Какие разновидности ковалентной связи вы знаете? Приведите примеры. 26 Какую химическую связь называют ионной? Каков механизм её образования? Чем она отличается от ковалентной? 27 Что понимают под степенью окисления элемента? Как определить высшую и низшую степени окисления исходя из положения элемента в периодической таблице Менделеева? 28 Какую химическую связь называют донорно-акцепторной? Приведите примеры, укажите донор и акцептор. 29 Какую химическую связь называют водородной? Как она влияет на свойства 30 Охарактеризуете силы межмолекулярного взаимодействия. 31 Гибридизация атомных орбиталей и конфигурация молекул
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1218; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.01 с.) |

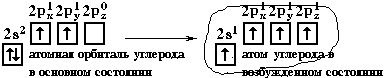
 Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.
Электронная конфигурация валентной оболочки бериллия 2s2. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние.


 Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то наблюдается sp2-гибридизация, которая даёт несколько иную геометрию молекулы. Примером может служить sp2-гибридизация бора при образовании молекулы BF3 (рисунок 14). Три sp2-гибридные орбитали лежат в одной плоскости под углом 120°. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника.
 Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).
Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра (рисунок 15).