Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формирование долговременных компенсаторных процессов.Содержание книги
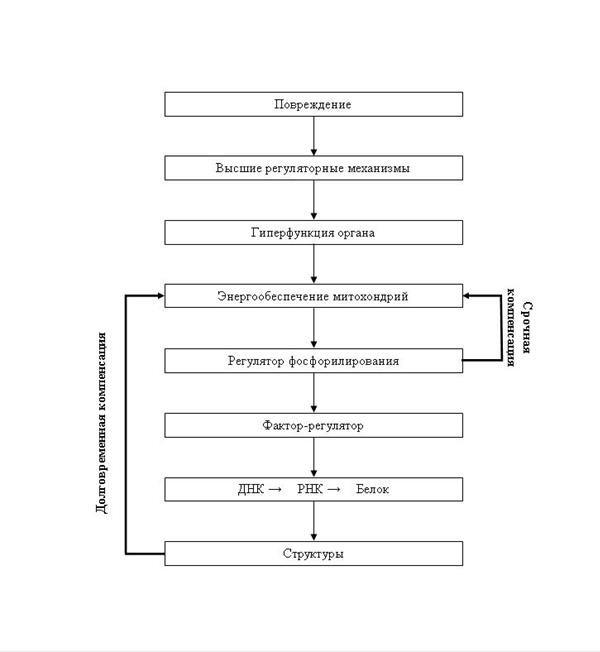
Поиск на нашем сайте Превращение срочной компенсации в долговременную составляет ключевой момент компенсаторных процессов. Заключается в увеличении мощности функциональной системы и проявляется в гипертрофии органов, которые осуществляют компенсацию нарушений. Клеточный регуляторный механизм (увеличение скорости транскрипции РНК на структурных генах ДНК в клеточных ядрах), связывающий уровень функции клетки с ее генетическим аппаратом и тем самым обеспечивающий формирование структурных основ долговременной компенсации, определяют как взаимосвязь между функцией и генетическим аппаратом клетки. Данная взаимосвязь как необходимое звено всех долговременных адаптационных реакций наблюдается на всех уровнях регуляторной иерархии организма. Повреждение через высшие регуляторные механизмы вызывает гиперфункцию органа. Механизм саморегуляции в клетке можно представить следующим образом: гиперфункция клеток органа приводит к увеличению использования креатинфосфата и АТФ; отношение концентрации продуктов распада креатинфосфата и АТФ к концентрации самих этих соединений, обозначенное как фактор – регулятор фосфорилирования (РФ) возрастает; возросшая величина РФ активирует дыхание и сопряженное с ним окислительное фосфорилирование митохондрий. Возросший ресинтез АТФ прекращает дальнейшее снижение концентарции АТФ в клетке – срочная компенсация оказывается обеспеченной (схема 3).
Схема 3. google_protectAndRun("ads_core.google_render_ad", google_handleError, google_render_ad); Внутриклеточное звено компенсации. В дальнейшем возросшая величина РФ, действуя опосредованно через фактор – регулятор (промежуточное звено), активирует генетический аппарат клетки, увеличивает скорость транскрипции РНК и тем самым вызывает рост клеточных структур. Развивается компенсаторная
Схема 4. Основные стадии долговременной компенсации.
гипертрофия – основа долговременной компнсации (схема 4). Компенсация, как и адаптивная реакция проходит четыре основные стадии: 1. стадия срочной компенсации, характеризующаяся компенсаторной гиперфункцией и выраженным синдромом стресса. 2. переходная стадия –– от срочной компенсации к долговременной, характеризующаяся сочетанием компенсаторной гиперфункции и синдрома стресса с активацией синтеза нуклеиновых кислот и белков в клетке. 3. стадия устойчивой долговременной компенсации, характеризующаяся ликвидацией или значительным уменьшением функционального дефекта. Длительность этой стадии при пороках сердца, утрате легкого или почки может соответствовать видовой продолжительности жизни. 4. стадия функциональной недостаточности может развиваться при большом функциональном дефекте и чрезмерной гиперфункции и гипертрофии компенсирующих систем или в результате дополнительных повреждений организма. Эта стадия знаменует переход компенсаторного процесса в декомпенсацию. При длительном действии патогенного фактора в организме развиваются адаптационные и компенсаторные механизмы. Адаптация (приспособление) – изменение структуры и метаболизма, способствующие оптимальному функционированию организма в новых условиях существования. При повторном контакте с этиологическим фактором развивается ряд условно-рефлекторных реакций, абеспечивающих адаптацию и снижающих агрессивное действие повреждающего агента (слезотечение, тахикардия, повышение АД), в этом состоит их гомеостатическая роль. Механизмы адаптации выработаны в ходе эволюции, направлены на сохранение гомеостаза. При чрезмерном действии патогенного фактора, когда адаптационных механизмов недостаточно и нарушается гомеостаз, в реакцию организма включаются компенсаторные механизмы. Компенсация– перестройка взаимоотношений между элементами системы, направленная на обеспечение полноценной функции при повреждении специфических структур, ответственных за выполнение данной функции в норме. При развитии заболевания, разграничить адаптационные и компенсаторные механизмы очень трудно, они действуют вместе, но решающую роль играют последние. Реактивность – свойство организма отвечать изменением жизнедеятельности на воздействия окружающей среды. Реактивность формировалась в процессе эволюционного развития видовых, наследственных качеств организма. Понятие реактивности тесно связанос резистентностью, означающей устойчивость организма к действию различных повреждающих факторов. Реактивность представляет общее обозначение механизмов резистентности организма, а резистентность – выражение процессов реактивности как защитно-приспособительного акта. Понятие реактивности установилось в начале XX века, когда стали известны явления аллергии. Реактивность является важным элементом патогенеза болезней. Патологическая реактивность характеризуется снижением приспособительных возможностей организма человека. В процессе эволюции механихмы реактивности изменялись. Чем менее организован живой организм, тем менее развита нервная система, тем в более простой форме выражается реактивность. Чем выше организовано живое существо, тем больше возможностей реагировать на различные влияния среды, и, прежде всего, это осуществляется нервной системой. Безусловные и условные рефлексы являются основой этой деятельности. Такие простые рефлексы как оборонительный, реакции освобождения (кашель, чихание, рвота), сложные реакции (воспаление, лихорадка, аллергия) являются механизмами реактивности, определяющими ее приспособительное значение. Благодаря реакциям нервной системы, в поврежденном организме возникают изменения жизнедеятельности, направленные на поддержание его существования в условиях возникшего повреждения. Существует измененная реактивность больного человека, обозначаемая термином – патергия. Изучение измененной реактивности положено в основу исследования аллергических болезней. Установлено, что пищевые и токсические дистрофии, рахит, гиповитаминозы сопровождаются понижением реактивности. Быстрое заживление раны свидетельсвует о высокой реактивности организма. Состояние усиленной реактивности называют гипергией, а состояние уменьшенной реактивности – гипоргией. Качественным показателем реактивности является устойчивость организма к действию повреждающих факторов. Не всегда усиленная реактивность вызывает адекватную реакцию организма. Например, при анафилактическом шоке реактивность увеличена, но сопровождается ослаблением сопротивления организма к действию повреждающего фактора. С другой стороны, зимняя спячка у некоторых животных сопровождается снижением реактивности, что является для организма приспособительной реакцией. Виды реактивности. Основными видами реактивности являются биологическая (видовая), групповая (типовая), индивидуальная и патологическая реактивность. Основой реактивности является биологическая. Под биологической реактивностью понимают защитно-приспособительные изменения, возникающие под влиянием обычных (адекватных) раздражителей окружающей среды. Она направлена на сохранение вида и индивидуума, и именно на ее основе формируется реактивность каждого индивида. На основе видовой реактивности выделяют группову. По типам высшей нервной деятельности, иммуногенетическим признакам крови, конституциональным типам выделяют групповую реактивность. Индивидуальная реактивность зависит от наследственных, конституциональных свойств, возраста, пола и воздействий факторов среды. Важнейшими факторами, определяющими индивидуальную реактивность являются: тип высшей нервной деятельности, особенности вегетативной нервной системы, эндокринных желез и интенсивность обменных и метаболических реакций организма. Установлено, что животные, перенесшие перегревание, переохлаждение, механическую травму, приобретают патологическую реактивность к кровопотере. При утрате 15-20% общей массы крови может наступить смерть, в то время как интактные животные способны перенести кровопотерю в 65-70%. Наркоз изменяет реактивность, тормозит выработку антител и угнетает фагоцитарную активность лейкоцитов, однако, при наркозе выспаление развивается более медленно, принимает затяжной характер и сопровождается некрозом пораженной ткани. В реактивности организма играют роль нервная, эндокринная системы, соединительная ткань и алиментарный фактор с учетом периодов онтогенеза.
Наследственные болезни. В последнее время ведущее место в структуре заболеваемости населения занимают болезни, в которых генетические факторы играют ведущую роль. Причины увеличения частоты наследственных форм патологий.1. Ликвидация и уменьшение частоты ряда инфекционных и алиментарных заболеваний.2. Увеличение средней продолжительности жизни человека.3. Рост числа и разнообразия мутагенных факторов в окружающей среде.4.Совершенствование методов диагностики наследственных форм патологий.Основная причина наследственных заболеваний - мутация.Мутационная изменчивость связана с процессом образования мутаций. Мутации – это внезапные, скачкообразные, стойкие изменения в наследственном аппарате клетки, не связанные с обычной рекомбинацией генетического материала. Мутационная теория была создана Гуго де Фризом в 1901-1903 гг. На основных ее положениях строится современная генетика.В зависимости от того, какой признак положен в основу, на сегодняшний день существует несколько систем классификации мутаций. Классификация мутаций:1. По способу возникновения. Различают спонтанные и индуцированные мутацииСпонтанные мутации, возникающие при нормальных условиях жизни. Происходят в природе крайне редко с частотой 1-100 на миллион экземпляров данного гена. В настоящее время, очевидно, что спонтанный мутационный процесс зависит как от внутренних, так и от внешних факторов, которые называют мутационным давлением среды.Метод определения спонтанных мутаций основан на том, что у детей появляется доминантный признак, хотя у его родителей он отсутствует. Проведенные в Дании исследования показали, что примерно одна из 24000 гамет несет в себе доминантную мутацию.Индуцированны е мутации возникают при воздействии на человека мутагенов – факторов, вызывающих мутации. Мутагены различают: -Физические (ионизирующая радиация, электромагнитное излучение, давление, температура и т.д.), первое место занимает ионизирующее и ультрафиолетовое виды излучений, которые способны вызвать мутацию в минимальной дозе радиации, которая не вызывает гибель или лучевое поражение всего организма, а потомство находится под угрозой развития болезни.-Химические (цитостатики, спирты, фенолы, аналоги пуриновых и пиримидиновых оснований, свободные радикалы некоторые антибиотики, антиметаболиты и т.д.)-Биологические (бактерии и вирусы), могут поражать как соматические, так и половые клетки (краснуха, вирусный гепатит)- истинные и косвенные - сами по себе не мутагены, но в организме превращаются в сильные мутагены (нитраты - нитриты). Индуцированный мутагенез – это искусственное получение мутаций с помощью мутагенов различной природы. Впервые способность ионизирующих излучений вызывать мутации была обнаружена Г.А. Надсоном и Г.С. Филлиповым. Затем, проводя обширные исследования, была установлена радиобиологическая зависимость мутаций. В 1927 году американским ученым Джозефом Мюллером было доказано, что частота мутаций увеличивается с увеличением дозы воздействия. 2. По отношению к зачатковому пути. Существуют соматические и генеративныемутации. Генеративные мутации возникают в репродуктивных тканях и поэтому не всегда выявляются. Для того, чтобы выявилась генеративная мутация, необходимо, чтобы мутантная гамета участвовала в оплодотворении. Последствия соматической мутации связаны только с судьбой данного организма, с его гибелью исчезают последствия мутации. 3. По адаптивному значению. -положительные-отрицательные (смертельные и не смертельные) -нейтральные мутации Эта классификация связана с оценкой жизнеспособности образовавшегося мутанта. 4.По локализации в клетке. -ядерные-цитоплазматическиеПлазматические мутации возникают в результате мутаций в плазмогенах, находящихся в митохондриях. Полагают, что именно они приводят к мужскому бесплодию. Причем такие мутации в основном наследуются по женской линии. 5. По изменению генотипа. -генные-хромосомные-геномные Генные (точковые) мутации обусловлены изменением химического строения гена, а именно последовательности пуриновых и пиримидиновых оснований участка ДНК. При этом один нуклеотид может превратиться в другой, может выпасть (делеция), продублироваться, а группа нуклеотидов может развернутся на 180 градусов. Механизмы реализации патогенных генов у взрослого человека:1. прекращение синтеза структурного белка;2. прекращение синтеза фермента;3. прекращение синтеза информационной РНК;4. синтез информационной РНК, кодирующей структуру аномального белка;5. синтез эмбрионального белка;6. транслокация гена.Наиболее вероятная мутация генов происходит при близкородственных браках, когда накапливается генетический груз. Хромосомные мутации приводят к изменению числа, размеров и организации хромосом, поэтому их иногда называют хромосомными перестройками. Хромосомные перестройки делятся на внутри- и межхромосомные.К внутрихромосомным относятся-Дупликация – один из участков хромосомы представлен более одногораза;-Делеция – выпадение внутреннего участка хромосомы;-Инверсия – поворот участка хромосомы на 180 градусов;Межхромосомные перестройки (транслокации) делятся на:- реципрокные – обмен участками негомологичных хромосом;- нереципрокные – изменение положения участка хромосомы;- дицентрические – слияние фрагментов негомологичных хромосом;- центрические – слияние центромер негомологичных хромосом.Хромосомные мутации проявляются у 1% новорожденных. Однако, исследования показали, что нестабильность соматических клеток здоровых доноров не исключение, а норма. В связи с этим была высказана гипотеза о том, что нестабильность соматических клеток следует рассматривать не только как патологическое состояние, но и как адаптивную реакцию организма на измененные условия внутренней среды. Хромосомные мутации могут обладать фенотипическими проявлениями. Наиболее распостраненный пример – синдром "Кошачьего крика" (плачь ребенка напоминает мяукание кошки). Обычно носители такой делеции погибают в младенчестве. Геномные мутации Главная отличительная черта геномных мутаций связана с нарушением числа хромосом в кариотипе. Эти мутации так же подразделяются на два вида:-полиплоидные;-анеуплоидные. Полиплоидные мутации ведут к изменению хромосом в кариотипе, которое кратно гаплоидному набору хромосом. Этот синдром впервые был лишь обнаружен в 60-х годах. Вообще полиплодия характерна в основном для человека, а среди животных встречается крайне редко. При полиплоидии число хромосом в клетке насчитывается по 69 (триплодие), а иногда и по 92 (тетраплодие) хромосомы. Такое изменение ведет практически к 100% смерти зародыша.Триплодие имеет не только многочисленные пороки, но и приводит к потере жизнеспособности. Тетраплодие встречается еще реже, но так же зачастую приводит к летальному исходу. Анеуплоидные же мутации приводят к изменению числа хромосом в кариотипе, некратное гаплоидному набору. В результате такой мутации возникают особи с аномальным числом хромосом. Как и триплодия, анеуплодия часто приводит к смерти еще на ранних этапах развития зародыша. Причиной же таких последствий является утрата целой группы сцепления генов в кариотипе.Механизм возникновения геномных мутаций связан с патологией нарушения нормального расхождения хромосом в мейозе, в результате чего образуются аномальные гаметы, что и ведет к мутации.Изменения в организме связаны с присутствием генетически разнородных клеток. Такой процесс называется мозаицизм.В результате геномных мутаций развивается синдром Дауна, синдром Клайнфельтера и др.Не каждая мутация ведет к изменению в организме. На уровне клетки существует особая система репарации поврежденной ДНК. Подавляющее число мутаций не имеет последствий для организма, т.к. только 5% генов функционируют, а остальные находятся в репрессивном состоянии. Антимутагенез Антимутаген - соединение, нейтрализующее мутаген или препятствующее действию мутагена, или препятствующее превращению косвенного мутагена в истинный мутаген.Дисмутагены - предохраняют от действия мутагенов внешнего происхождения (сок капусты, редьки, яблок).1. Антимутагены, подавляющие процесс образования истинного из косвенного (вит. Е, С; фенолы). 2. Антимутагены, повышающие активность ферментных систем, блокирующих мутагены. 3.Антимутагены, подавляющие активность свободных радикалов (вит. С, Е, соединения селена).4. Вит. С, Е, А, К - антимутагены универсальные.Самые грубые нарушения генетического аппарата вызывают гибель организма. Если мутация не летальна и сохранена способность организма воспроизводить потомство, то дефект будет передаваться по наследству. Последствия будут зависеть от того, доминантный или рецессивный мутантный ген. Доминантные гены сильнее контролируются отбором. Рецессивные патологические гены проявляются, если находятся в гомозиготном состоянии. В гетерозиготном состоянии в популяции накоплено большое число мутантных генов – гетерозиготное носительствоПроявление патологического гена определяется такими свойствами, как -пенетрантность– вероятность фенотипического проявления гена ( отношение числа больных особей к числу носителей патологического гена);-экспрессивность – степень клинического проявления гена, может быть слабой и сильной. Эти свойства зависят от экзогенных и эндогенных факторов. Если для проявления гемофилии решающее значение имеет нарушение в геноме, то развитие сахарного диабета зависит от взаимодействия генетических факторов и внешней среды. В этом случае говорят о наследственном предрасположении. Наследственные болезни - передающиеся потомству болезни, обусловленные изменением наследственной информации - генными, хромосомными и геномными мутациями. Термины "наследственные болезни" и "врожденные болезни" не являются синонимами. Врожденными называют болезни, которые выявляются с рождения, не связаны с изменением генетического аппарата у родителей, возникают в процессе внутриутробного развития организма и не передаются его потомству. Признаками врожденных болезней с измененной генетической программой являются:-патология не выявляется в родословной данного пациента;-могут передаваться по наследству от заболевших родителей потомкам-выявлены аномалии в генетической программе пациента (краснуха).Например, пороки развития могут возникать не только при генетических нарушениях, но и в результате действия на зародыш инфекционных факторов, ионизирующего излучения, химических соединений, лекарственных средств. На ранних стадиях развития зародышей существуют относительно короткие периоды наивысшей чувствительности плода к различным воздействиям – критические периоды. Учение о критических периодах обосновал известный советский эмбриолог П.Г.Светлов. Первый критический период падает на первые три недели беременности, то есть до имплантации эмбриона в слизистую оболочку матки. В этот период происходит обособление всех основных эмбриональных зачатков, определяются пути развития различных групп клеток, из которых впоследствии возникают ткани и органы будущего организма. Второй критический период – это примерно 3-я и 7-я недели беременности. В начале этого периода образуется плацента, формируется нервная система, орган зрения, внутренние органы, конечности. Неблагоприятные воздействия на плод в первом критическом периоде наиболее часто приводят к гибели. Патогенные влияния в течение 2-го критического периода могут сопровождаться гибелью зародыша или возникновением разнообразных пороков развития: аномалии скелета, пороки сердца, нарушения развития нервной системы и органов чувств и др.Наследственные болезни не всегда бывают врожденными, поскольку многие из них проявляются не сразу после рождения, а спустя несколько лет, иногда десятилетий (хорея Геттингтона развивается в возрасте старше 40 лет). В качестве синонима термина "наследственные болезни" не следует также употреблять термин "семейные болезни", т. к. последние могут быть обусловлены не только наследственными факторами, но и условиями жизни или профессиональными традициями семьи. О наследственном характере заболевания свидетельствует высокая конкордантность болезни у однояйцевых (монозиготных) близнецов, живущих в разных, резко контрастирующих условиях.Не передаются по наследству гипогенитальные, летальные и сублетальные заболевания, что связано с невозможностью воспроизведения жизнеспособного потомства. Известно около 3 тысяч наследственных болезней и синдромов, определяющих довольно значительный "генетический груз" человечества.Наследственные болезни подразделяют на три основные группы:1.моногенные, обусловленные дефектом одного гена;2.полигенные (мультифакторные), связанные с нарушением взаимодействия нескольких генов и факторов окружающей среды;3.хромосомные, возникающие вследствие изменения количества или структуры хромосом. Моногенные болезни чаще всего обусловлены мутацией структурных генов; этиологическая роль мутаций генов-регуляторов при некоторых болезнях доказана лишь косвенно. По типу наследования моногенные болезни делят на: аутосомно-доминантные, аутосомно-рецессивные сцепленные с полом.При аутосомно-доминантном типе наследования действие мутантного гена проявляется практически всегда. Вероятность развития болезни в потомстве составляет 50%. Больные мальчики и девочки рождаются с одинаковой частотой. Один из родителей больного ребенка обязательно болен.Характерные черты аутосомно-доминантных форм наследственной патологии: 1. Патологический признак встречается в каждом поколении родословной и проявляется у гетерозиготных носителей гена. Если сибсов в данном поколении много, соотношение больных и здоровых сибсов приближается к 1:1. 2. Полная пенетрантность патологических проявлений наблюдается далеко не всегда. Чаще всего она ниже 100%, в том или ином поколении могут встретиться индивиды без выраженных признаков болезни, но являющихся гетерозиготами, о чём свидетельствует появление болезни у части их детей. 3. Для доминантно-наследуемых состояний характерна различная выраженность клинических проявлений не только между разными семьями, но и внутри каждой семьи. Например, при множественном нейрофиброматозе у одних членов семьи нейрофибромы распространены генерализванно, а у других – имеются лишь отдельные кожные поражения. 4. Клинические проявления некоторых доминантных болезней могут развиваться спустя ряд лет после рождения, и по сроку появления имеется также большая вариабельность между членами разных семей и даже в одной семье. По аутосомно-доминантному типу наследуются главным образом болезни, в основе которых лежит нарушение синтеза структурных белков или белков, выполняющих специфические функции (гемоглобина). По доминантному типу наследуются скелетные и другие аномалии, не препятствующие размножению и не сокращающие продолжительность жизни (коротколапость, многолапость, близорукость, дальнозоркость, полидактилия, брахидактилия, астигматизм и др.). При аутосомно-рецессивном типе наследования мутантный ген проявляется только в гомозиготном состоянии, когда один рецессивный ген ребенок получает от отца, а второй - от матери. Вероятность рождения больного ребенка составляет 25%. Больные мальчики и девочки рождаются с одинаковой частотой. Родители больных детей могут быть внешне здоровы, но являются гетерозиготными носителями мутантного гена. Аутосомно-рецессивный тип наследования наиболее характерен для болезней обмена, при которых нарушена функция одного или нескольких ферментов (фенилкетонурия, альбинизм, алкаптонурия, агаммаглобулинемия Брутона, врожденная глухонемота, микроцефалия, дальтонизм и др). Рецессивное наследование, сцепленное с Х-хромосомой, заключается в том, что действие мутантного гена проявляется только при XY-наборе половых хромосом, т. е. у мальчиков (девочки имеют половой набор XX). Родители больного ребенка могут быть здоровы, но если мать является носительницей мутантного гена, вероятность рождения больного мальчика составляет 50%. Девочки в этом случае рождаются здоровыми, но половина из них является носительницами мутантного гена (так называемые кондукторы). Доминантное наследование, сцепленное с Х-хромосомой, заключается в том, что действие доминантного мутантного гена проявляется в любом наборе половых хромосом (XX, XY, ХО и др.), т. е. независимо от пола. Более тяжело заболевание протекает у мальчиков. Один из родителей больного ребенка обязательно болен. Среди детей больного мужчины все сыновья здоровы, а дочери больны. Больные женщины передают измененный ген половине сыновей и дочерей. Данный тип наследования прослеживается при рахитоподобном заболевании - фосфат-диабете.Полигенные (мультифакторные) болезни, или болезни с наследственным предрасположением, обусловлены взаимодействием нескольких генов (полигенные системы) и факторов окружающей среды. К этим болезням относят подагру, некоторые формы сахарного диабета, конституционально-экзогенное ожирение, гипертоническую болезнь, многие хронические болезни почек, печени, желудочо-кишечного тракта, аллергические заболевания, атеросклероз и др. Полигенные болезни наблюдаются примерно у 20% населения, патогенез их изучен недостаточно. Предполагают, что они чаще проявляются при постоянном воздействии неблагоприятных факторов окружающей среды (нерациональное питание, переутомление и др.). Большое значение имеет выявление так называемых маркеров наследственной предрасположенности к определенному заболеванию. Например, аллергический диатез может быть диагностирован на основании повышенного содержания в крови иммуноглобулина Е и повышенной экскреции метаболитов триптофана с мочой. Определены биохимические маркеры наследственной предрасположенности к сахарному диабету (снижение толерантности к глюкозе, определение иммунореактивного инсулина), конституционально-экзогенному ожирению и гипертонической болезни (повышение содержания липопротеинов в крови - гиперлипопротеинемия). Связь с антигенами тканевой совместимости (HLA) обнаружена примерно для 90 заболеваний человека, многие из которых характеризуются иммунными нарушениями. Хромосомные болезни - формы патологии, клинически выражающиеся множественными врожденными пороками развития, генетическая основа - изменение числа хромосом или нарушение строения хромосомы.Различают полные хромосомные болезни - изменение хромосомного набора в гамете.Мозаичные хромосомные болезни - изменение хромосомного набора в зиготе (часть клеток имеет нормальный набор хромосом).Моноплоидия - несовместима с жизнью на ранних этапах развития.Недостаток генетического материала вызывает более выраженные дефекты, чем избыток.Нарушения крупных и средних хромосом - несовместимы с жизнью. Обусловлены геномными (изменение общего числа хромосом) и хромосомными (структурная перестройка хромосом) мутациями. Если они произошли в половых клетках, то изменения передаются всем клеткам организма - развиваются так называемые полные формы хромосомных болезней. В тех случаях, когда мутация возникла на ранних стадиях дробления зародыша, аномалии числа или структуры хромосом будут наблюдаться только в части клеток организма, и заболевание проявится в неполной, или мозаичной, форме. Частота хромосомных болезней у новорожденных примерно 6:1000. У Наиболее часто наблюдаются хромосомные болезни, обусловленные трисомией (появлением дополнительной хромосомы в одной из пар хромосом), например, болезнь Дауна, характеризующаяся трисомией 21-й пары хромосом. При отсутствии одной из половых хромосом (половой набор ХО) развивается синдром Шерешевского-Тернера. Родители детей с хромосомными болезнями часто здоровы. Все трисомии представляют собой спорадические случаи, т. е. следствие вновь возникших мутаций. Половина всех случаев структурных перестроек хромосом - семейные случаи. Риск повторного проявления большинства хромосомных болезней в семье не превышает 1%. Исключение составляют болезни, обусловленные транслокациями (переносом фрагмента одной хромосомы на другую), при которых степень риска повторного рождения больного ребенка достигает 30% и более. Вероятность появления хромосомных мутаций и риск рождения больного ребенка резко увеличивается у женщин старше 35 лет. Таким образом, возможные нарушения:1. Выпадения нормальной наследственной информации (синдром кошачьего крика).2. Увеличение нормальной наследственной информации (трисомии).3. Замена нормальной наследственной информации на патологическую (фенилкетонурия и др.).4. Стойкие нарушения регуляции генной активности.5. Нарушение репарации поврежденной ДНК (пигментная ксеродерма - повышенная чувствительность к УФО, гиперкератоз; нарушение выработки фермента экзонуклеазы (вырезание димеров).Фенокопии- изменения признаков организма под влиянием факторов внешней среды в период эмбрионального развития, по основным проявлениям, сходные с наследственной патологией. Причины фенокопий: 1.Кислородное голодание плода.2 Болезнь матери при беременности.3. Психическая травма у беременной.4. Эндокринные заболевания у беременной5. Питание беременной (недостатки С, В, Р, РР вит., Со, Са, Fe).6. Лекарственные препараты при беременности (антибиотики, сульфаниламиды. 6. Повреждение клетки. Живая клетка - это тот универсальный уровень биосистем, на котором все разнообразие функций, присущих организмам любой сложности, проявляется в минимальном количестве связей и отклонений. Клетка как целостная система осуществляет свою деятельность в среде, обеспечивающей ее существование и функционирование, перестраивая, организовывая свои элементы - субклеточные единицы различного уровня - в зависимости от характеристик среды. Важно подчеркнуть, что функции субклеточных органелл не строго детерминированы, поэтому они могут участвовать в различных внутриклеточных процессах. Главной функцией клетки является осуществление обмена со средой веществом, энергией и информацией, что подчинено, в конечном счете, задаче сохранения клетки как целого при изменении условий существования. От нарушения элементарных структур клетки и их функций к патологии клетки как элементарной саморегулирующейся живой системе и к патологии клеточных образований, объединенных конечной функцией - таков путь познания структурной основы патологии человека.Повреждение клетки – это типовой патологический процесс, проявляющийся нарушением гомеостаза клетки под действием повреждающих факторов и характеризующийся морфологическими, функциональными нарушениями и активизацией компенсаторно-приспособительных механизмов. В наиболее общем смысле, повреждение организма на любом уровне (молекулярном, клеточном, органном) представляет собой такое изменение его структуры и функции, которое не способствует, а мешает жизни и существованию организма в окружающей среде. Авцин А.П. и Шахламов В.А. (1979) определяют повреждение как нарушение структурной и функциональной организации живой системы, вызванное различными причинами. С точки зрения развития процессов в самой общей форме - это нарушение клеточного обмена веществ, появление дистрофии, паранекроза, некробиоза и, наконец, некроза, если клетка погибает. При повреждении клетки структурных и функциональных изменения встречаются, как правило, в трех вариантах: 1) соответствие морфологических и функциональных нарушений; 2) преобладание структурных изменений над функциональными; 3) преобладание функциональных расстройств над структурными изменениями; Причины повреждения клетки:1. экзогенные факторы (химической, физической, биологической природы);2. эндогенные факторы.Виды повреждения клетки:I. обратимое и необратимое II. острое и хроническоеIII. прямое и опосредованноеIV. специфическое и неспецифическоеФункциональные проявления острого повреждения клетки: ● преддепрессионная гиперактивность; ● парциальный некроз; ● тотальное повреждение.Эти проявления составляют сущность острого повреждения клетки в зависимости от ее строения, исходного функционального состояния, вида этиологического фактора и механизма его действия.Преддепрессионная гиперактивность возникает вследствие обратимого повреждения клетки патогенными факторами умеренной интенсивности. В результате этого в мембране клетки происходит неспецифическое возбуждение аденилатциклазной системы, активация образования вторичных мессенджеров (посредников), усиление деятельности органелл, в первую очередь митохондрий. Это приводит к усилению окисления субстратов и синтеза АТФ. Одновременно с этим мобилизуются все энергозависимые процессы, направленные на повышение резистентности клетки к патологическому фактору. В результате, если воздействие этого фактора ограничено, может произойти "выздоровление" клетки с последующим восстановлением первоначальной структуры и функции. По Меерсону, после этого в генетическом аппарате клетки образуется так называемый "системный структурный след", запоминающий происшедшее воздействие и облегчающий адаптацию клетки при повторном воздействии повреждающего фактора. В случае парциального некроза, поврежденная часть клетки отделяется от функционирующей части вновь образующейся компенсаторной "демаркационной" мембраной и уничтожается фагоцитами. После этого структура и функция клетки восстанавливается за счет гиперплазии субклеточных единиц. При длительном и интенсивном действии повреждающего фактора происходит тотальное повреждение клетки, что приводит к депрессии функции митохондрий, снижению синтеза макроэргов, нарушению энергозависимого клеточного транспорта. При повреждении лизосом выходят в цитоплазму гидролитические ферменты, что приводит к структурной дезорганизации органелл и мембран. Эта фаза острого повреждения клетки, когда еще сохраняется небольшой градиент концентрации электролитов между цитоплазмой и внеклеточной средой, называется "агонией" клетки. Исчезновение мембранного потенциала в результате выравнивания концентраций Na+ и К+ по обе стороны мембраны характеризует смерть клетки. Особенности реакции клетки на повреждающий фактор зависят как от его характеристики, так и от типа клетки по ее способности к делению, обеспечивающей возможность рекомпенсации. В настоящее время принято считать, что в организме имеются три категории специализированных клеток по их способности к делению.● Клетки I категории, к моменту рождения в первый период жизни достигают высокоспециализированного состояния структур за счет минимизации функций. В организме отсутствует источник возобновления этих клеток в случае их дисфункции. К таким клеткам относятся нейроны. Клетки I категории способны к внутриклеточной регенерации, в результате которой восстанавливается утраченные части клеток, если сохранены ядерный аппарат и трофическое обеспечение.● Клетки II категории - высокоспециализированные клетки, выполняющие специфические функции и затем либо "изнашивающиеся", либо слущивающиеся с различных поверхностей. Подобно клеткам I категории, они не способны размножаться, однако в организме имеется механизм для их непрерывного воспроизводства. Такие клеточные популяции называются обновляющимися, а состояние, в котором они находятся - стационарным. К ним, например, относятся клетки, выстилающие большую часть кишечника.● Клетки III категории - отличаются большой продолжит
|
||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 7208; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.141 (0.017 с.) |