
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Исследование углеводородов нефтИ и нефтепродуктовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
I. Исследование углеводородов нефтИ и нефтепродуктов Фракционный состав нефти Наиболее важным источником углеводородов являются нефть и горючие (природные и попутные) газы. Нефть представляет собой сложную смесь органических соединений, прежде всего углеводородов: алканов, циклоалканов и аренов. Каждый ряд углеводородов представлен соединениями различной молекулярной массы и различного строения, которые распределены по всем фракциям нефти. Распределение различных групп углеводородов по фракциям зависит также от типа нефти. Фракционный состав характеризует потенциальное содержание различных фракций в составе нефти, прежде всего светлых. Определение фракционного состава является обязательной операцией как при изучении химического состава нефтей, так и при выборе направления ее переработки. Основой этого метода является дистилляция (перегонка), т.е. разделение нефти на фракции по температурам кипения. При исследовании химического состава новых нефтей фракционный состав определяют перегонкой нефти в специаль-ных аппаратах. От начала кипения до 300оС отбирают десятиградусные фракции, а затем пятидесятиградусные фракции до фракций с концом кипения 475-550оС (от 200 до 550оС перегонку проводят под вакуумом). В условиях промышленной переработки нефть разделяют перегонкой при атмосферном давлении на фракции со следующими пределами выкипания: Бензин н.к. - 180-200оС Керосин 200-270оС Газойль 270-350оС Мазут > 350оС Нефти различных месторождений значительно отличаются друг от друга по фракционному составу и, следовательно, по потенциальному содержанию бензиновых, керосиновых, газойлевых и масляных фракций. Сущность метода определения фракционного состава заключается в перегонке 100 см3 испытуемой нефти при условиях, предусмотренным стандартом ГОСТ 2177-82.
Экспериментальная часть. Лабораторная работа №1 Подготовка к испытанию Разгонка проводится на аппарате АРНП-2, внешний вид которого представлен на рис.1.
        
Рис.1. Аппарат для перегонки АРНП-2: 1 – термопара; 2 – колба для перегонки; 3 – электрический нагревательный элемент; 4 – ручка для регулирования положения колбы; 5 – индикатор температуры; 6 – диск для регулирования нагрева; 7 – выключатель; 8 – подставка для установки мерного цилиндра; 9 – охлаждающая баня; 10 – трубка холодильника.
1)Сухим чистым цилиндром отмеряют 100 см3 предварительно обезвоженной нефти (при перегонке допускается воды в нефти не более 0,1-0,2%.) и осторожно переливают ее в колбу 2 так, чтобы жидкость не попала в отводную трубку колбы. 2) В горловину колбы с нефтью вставляют термопару 1 на плотно пригнанной пробке так, чтобы ось термопары совпадала с осью шейки колбы, а конец термопары находился на уровне нижнего края отводной трубки в месте её припая. 3) Колбу с нефтью ставят на асбестовую прокладку над электрическим нагревательным элементом 3. Отводную трубку колбы соединяют с верхним концом трубки холодильника при помощи плотно пригнанной пробки так, чтобы отводная трубка входила в трубку холодильника на 25-40 мм и не касалась стенок последней. Затем ставят верхний кожух на асбестовую прокладку, закрывая колбу. 4) Под конец трубки холодильника 10 ставят чистый сухой цилиндр, так, чтобы трубка холодильника входила в цилиндр не менее чем на 25 мм, но не ниже отметки 100 см3, и не касалась его стенок. На время перегонки отверстие цилиндра закрывают ватой или листом фильтровальной бумаги. (Для варианта II берут три чистых сухих цилиндра на 50 см3 и предварительно взвешивают их. Цилиндр №1 устанавливают под конец трубки холодильника.) 5) Ванну холодильника 9 наполняют кусками льда или снегом и заливают водой так, чтобы она покрывала трубку холодильника. При перегонке нефти вначале температура воды в холодильнике должна быть 0-5oС. Перегонку ведут без подачи проточной воды в холодильник. 6) Включают нагрев 7 → 6. Проведение опыта 1) Отмечают температуру, показываемую термометром в момент падения первой капли конденсата с конца трубки холодильника в мерный цилиндр, записывают как температуру начала перегонки (начала кипения). 2) Затем мерный цилиндр устанавливают так, чтобы конденсат стекал по стенке цилиндра. Далее перегонку ведут с равномерной скоростью: вначале 2-5 см3 в 1 мин (2 капли в 1 с), а затем 2-2,5 см3 в 1 мин (одна капля в 1 с). Для проверки скорости перегонки по количеству капель цилиндр оставляют на короткий промежуток времени от конца трубки холодильника. Вариант I Перегонку нефти ведут до 300oС. При этом отмечают температуру начала кипения и объёмы дистиллятов при 100, 120, 140, 160oС и далее через каждые 20oС до 300oС. Обработка результатов Данные, полученные в ходе перегонки, вносят в таблицу: Таблица 1 Вариант II Отмечают температуру начала кипения и отбирают в первый цилиндр фракцию, выкипающую от н.к. до 180оС. Затем подставляют второй цилиндр, в который отбирают фракцию, выкипающую в пределах температуры 180-270оС. По достижении температуры 270оС подставляют третий цилиндр и отбирают фракцию 270-350оС. При температуре 350оС нагрев прекращают. Обработка результатов Определяют объем каждой полученной в ходе разгонки фракции. Затем взвешивают цилиндры с фракциями и, если достаточно дистиллята, определяют плотность фракции с помощью ареометра. Объем и массу остатка вычисляют по разности. Полученные данные вносят в таблицу 2 и рассчитывают материальный баланс фракционной перегонки нефти: Таблица 2 Меры безопасности 1. При выполнении анализа необходимо соблюдать правила противо-пожарной безопасности. Поскольку нефть и нефтепродукты – горючие вещества, при работе с ними не должно быть рядом открытого огня. 2. Перегонная колба должна быть установлена на асбестовую прокладку, чтобы не было непосредственного контакта колбы с нагреваемой поверхностью во избежание возникновения трещин на колбе. 3. Все соединения частей прибора должны быть плотно пригнаны друг к другу, чтобы не допускать прорыва паров отгоняемых фракций. 4. Необходимо следить за эффективностью охлаждения отходящих паров во избежание образования горючей паровоздушной смеси, а также отравления парами отгоняемых фракций. Контрольные вопросы 1. Какой процесс называется перегонкой? 2. Какие параметры фиксируются при фракционной перегонке нефти? 3. Какие фракции получаются при перегонке нефти? 4. За счет чего возникают потери при перегонке нефти? 5. Почему при атмосферной перегонке процесс ведут только до 300-350оС? 6. Что такое наложение фракций и с чем оно связано?
1.2. Методы получения и химические свойства углеводородов
Углеводороды – это органические соединения, молекулы которых состоят только из атомов углерода и водорода. Существует несколько типов такого рода соединений в зависимости от того, как соединены между собой атомы углерода. Они делятся на соединения с открытой цепью или ациклические, и соединения с замкнутой цепью или циклические.
*Выделены углеводороды, встречающиеся в нефти. Ряд углеводородов, объединенных общей молекулярной формулой, имеющих схожие строение и химические свойства, но отличающихся на одну или несколько групп –СН2- называется гомологическим рядом. Углеводороды с открытой цепью или ациклические углеводороды, в которых все связи углерод-углерод простые (одинарные: С-С), носят название алканов (насыщенных или парафиновых углеводородов). Они имеют общую формулу СnH2n+2 и характеризуются химической инертностью, т.е. не вступают в реакции при обычных условиях. Основной тип реакций – замещение. Другие типы гомологических рядов ациклических углеводородов - это алкены, алкадиены и алкины. Алкены (этиленовые углеводороды или олефины), соединения в молекуле которых помимо простых связей С-С имеются двойные углерод-углеродные связи С=С. Общая формула этого гомологического ряда СnH2n. Алкины (ацетиленовые углеводороды) – это углеводороды, в молекулах которых имеется тройная связь между атомами углерода С≡C. Oбщая формула гомологического ряда ацетиленовых углеводородов СnH2n-2. В молекулах углеводородов может быть несколько двойных и тройных связей. Например, алкадиены - углеводороды с двумя двойными связями в молекуле, с общей формулой СnH2n-2. Алкены, алкины и алкадиены относятся к непредельным соединениям. Присутствие двойных и тройных связей в молекуле заметно влияет на химические свойства этих углеводородов, делает их химически активными. Наиболее характерны реакции присоединения. Циклические углеводороды включают два гомологических ряда: алициклический и ароматический. Углеводороды алициклического ряда содержат кольца, состоящие из углеродных атомов, связанных между собою простыми связями, как, например, в циклогексане:
Ароматические углеводороды - соединения, имеющие в молекуле бензольное кольцо:
Химические свойства циклоалканов во-многом похожи на химические свойства алканов. Химические свойства аренов зависят от их строения. Сам бензол химически инертный. Гомологи бензола: толуол, этилбензол и др. химически более активны.
Экспериментальная часть. Лабораторная работа №2. Опыт 1. Получение и свойства метана В ступке растирают одну часть ацетата натрия (CH3COONa) с двумя частями натронной извести (NaOH). Смесь пересыпают в сухую пробирку с газоотводной трубкой и нагревают сначала осторожно, а затем сильно.
Чтобы убедиться в том, что метан трудно вступает в химические реакции, его пропускают в пробирки, наполненные раствором перманганата калия и бромной водой. Окраска растворов при этом не изменяется, так как в обычных условиях метан не окисляется и не вступает в реакции замещения.
Опыт 2. Получение и свойства этилена. В пробирку с газоотводной трубкой помещают 1 мл этилового спирта и, осторожно взбалтывая, приливают 4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку и начинают медленно и осторожно нагревать пробирку до начала равномерного выделения газа. Реакционная смесь при этом темнеет:
tо
H2SO4
Заранее готовят две пробирки, заполненные на 2/3 объема бромной водой и раствором перманганата калия. Как только из газоотводной трубки начинает выделяться этилен, опускают поочередно газоотводную трубку в эти пробирки. Непредельный характер этилена проявляется в быстроте его бромирования и окисления. Бромная вода обесцвечивается, так как бром присоединяется к этилену:
Br Br
При окислении этилена раствором перманганата калия образуется этиленгликоль, в результате чего также происходит обесцвечивание раствора:
OH OH
Эти две реакции (обесцвечивание бромной воды и раствора перманганата калия) используют как качественные реакции, позволяющие обнаруживать непредельные углеводороды в нефтепродуктах.
Опыт 3. Сравнение свойств жидких алканов и алкенов В качестве примера жидких парафиновых углеводородов возьмем н-гексан (СН3СН2СН2СН2СН2СН3). В качестве примера жидких алкенов возьмем гексен-1 (СН2=СН-СН2-СН2-СН2-СН3) В две пробирки наливают по 1 мл н-гексана и н-гексена. В обе пробирки прибавляют 0,5 мл бромной воды. В первой пробирке обесцвечивания не происходит, т.е. в обычных условиях н-гексан с бромом не реагирует. Во второй пробирке наблюдается исчезновение окраски, т.е. гексен-1 прореагировал с бромом:
Br Br
Затем, готовят опять две пробирки с н-гексаном и гексеном и приливают по 1 мл раствора перманганата калия (KMnO4). После встряхивания содержимого пробирок отмечают, что в первой пробирке изменений не происходит, раствор не обесцвечивается, т.е. реакция не идет. Во второй пробирке характерный фиолетовый цвет исчезает, т.к. гексен реагирует с KMnO4. Опыт 4. Получение и свойства ацетилена. В сухую пробирку помещают кусочки карбида кальция, затем прикапывают насколько капель воды и быстро закрывают пробирку пробкой с газоотводной трубкой. В пробирке наблюдается вспенивание за счет выделения газа. Газоотводную трубку опускают в пробирки с заранее приготовленными растворами бромной воды и перманганата калия. Наблюдается обесцвечивание растворов:
Br Br Арены Опыт 5. а) Бромирование бензола и толуола. В одну пробирку помещают 1 мл бензола, в другую - 1 мл толуола. В каждую из пробирок добавляют по 1 мл бромной воды и встряхивают. Пробирки нагревают на водяной бане. Бромирование бензола в этих условиях не происходит, а толуол бромируется - происходит исчезновение окраски брома. Бромирование бензола возможно только в присутствии катализатора (железные опилки). Если в первую пробирку добавить железных опилок, встряхнуть и нагреть на водяной бане, то произойдет исчезновение окраски, следовательно, бензол бромируется.
толуол орто-бром- пара-бром- толуол толуол
В молекуле толуола к ароматическому кольцу присоединена группа -СН3. Это заместитель I-го рода, он облегчает введение следующего заместителя в ароматическое кольцо и направляет его в орто- и пара-положения.
Опыт 6. Окисление ароматических углеводородов Опыт проводят одновременно с бензолом и толуолом. В две пробирки помещают по 1 мл раствора перманганата калия и разбавленной серной кислоты, затем добавляют по 0,5 мл в одну пробирку бензола, в другую -толуола. Сильно встряхивают каждую пробирку в течение нескольких минут. Отмечают изменение окраски в пробирках. Бензол весьма устойчив к окислению и практически не реагирует с перманганатом калия ни в кислой, ни в щелочной среде. (Если реакция идет, вероятно, бензол содержит примесь тиофена). Гомологи бензола окисляется значительно легче.
бензол
толуол бензойная кислота Опыт 7. Нитрование нафталина В пробирку наливают 2 мл концентрированной азотной кислоты. К азотной кислоте добавляют 0,5 г нафталина. Содержимое пробирки встряхивают и нагревают на горячей водяной бане 5 мин. Затем содержимое пробирки выливают в стаканчик с холодной водой. Образовавшийся нитронафталин выделяется в виде оранжевого масла, которое быстро затвердевает при встряхивании.
нафталин a-нитронафталин Нафталин нитруется значительно легче, чем бензол и толуол. Поэтому нитрование нафталина проводят не нитрующей смесью, а только концентрированной азотной кислотой.
Опыт 8. Качественная реакция на ароматические углеводороды (формалитовая реакция) Ароматические углеводороды образуют с формалином в присутствии серной кислоты ярко окрашенные продукты конденсации. Это свойство используют как качественную реакцию на присутствие ароматических углеводородов в нефтепродуктах. В фарфоровую чашечку капают 6-8 капель концентрированной серной кислоты, затем прибавляют 3-4 капли формалина и 2-3 капли исследуемого вещества. При отсутствии ароматических углеводородов смесь остается бесцветной. Появление яркого красно-бурого окрашивания свидетельствует о наличии ароматических углеводородов в испытуемом продукте. Меры безопасности 1. При выполнении опытов необходимо соблюдать правила противо-пожарной безопасности. Поскольку все органические вещества горючи, то при работе с ними надо соблюдать особую осторожность. Открытый конец нагреваемой пробирки не должен попадать в зону горелки. 2. Необходимо соблюдать осторожность при работе с концентрированными кислотами (опыты 2,7,8). Не допускать пролива кислот, попадания кислот на кожу. 3. Многие низкомолекуклярные углеводороды являются легколетучими соединениями, поэтому при выполнении опытов 3,5,6 следует брать строго рекомендованное количество углеводородов, не подносить к носу и не вдыхать пары углеводородов.
Контрольные вопросы 1. Какие гомологические ряды образуют углеводороды и каковы отличительные черты каждого из гомологических рядов. 2. Углеводороды каких гомологических рядов встречаются в нефтях? 3. Какие ряды углеводородов отличаются наибольшей химической активностью, с чем это связано? Какой тип реакций характерен для них? 4. Какие качественные реакции используются для выявления алканов, алкенов, алкинов, аренов? 5. Почему алкилзамещенные арены более химически активны, чем бензол? 1.3. Определение содержания аренов состава С8 В бензиновой фракции Знание углеводородного (УВ) состава нефтей и конденсатов на молекулярном уровне имеет большое значение как для нефтехимии и нефтепереработки, так и для интерпретации возможных путей происхождения этих горючих ископаемых, а именно, произошли ли они из органического вещества (ОВ) морского или озерного типа или из наземного гумусового вещества. Значительный интерес в этом отношении представляют собой арены состава C8. На основании систематического изучения распределения аренов состава С8 в нефтях установлено, что высокая концентрация этилбензола (более 17÷18%) и повышенная концентрация о -ксилола свидетельствуют об исходном ОВ сапропелевого морского или озерного типа, в то время как более низкие концентрации этилбензола (меньше 13÷14%) и преобладание м- ксилола свидетельствуют о гумусовом исходном ОВ. Вместе с тем, необходимо отметить, что эта закономерность характерна лишь для ОВ низкой и средней стадии зрелости. Для определения степени зрелости ОВ морского (сапропелевого) генезиса на основании распределения аренов состава C8 необходимо пользоваться отношением (мета- + пара -)ксилолы / орто -ксилол, в то время как в случае континентального (гумусового) ОВ – отношением (орто- + пара -) ксилолы / мета -ксилол. В случае сапропелевого ОВ первичными продуктами генезиса, скорее всего, являются этилбензол и o -ксилол (их концентрации значительно выше равновесных, табл. 3), в то время как м- и п -ксилолы (их концентрации ниже равновесных) образуются из о -ксилола в процессе катагенеза. Чисто гумусовое ОВ продуцирует преимущественно этилбензол и м- ксилол, (их концентрации значительно выше равновесных). При этом в процессе катагенеза из м- ксилола, образуются о- и п -ксилолы (их концентрации ниже равновесных). Известно, что даже в присутствии катализатора алюмо- Таблица 3 Распределение аренов состава С8 (%) в продуктах термокатализа над алюмосиликатом этилбензола и орто -ксилола
силиката этилбензол не изомеризуется в ксилолы (образуется бензол и толуол), также как и ксилолы не образуют этилбензол (табл. 3). Следовательно, в процессе катагенеза этилбензол с одной стороны, и о-, м- и п- ксилолы, с другой, преобразуются независимо друг от друга (рис. 2).
 
Рис. 2. Схема образования аренов состава C8
Для анализа полного УВ состава фракции до 180°С бензинов, ее разделяют на насыщенную – парафино-циклопарафиновую (ПЦП) – и ароматическую (арены) части. Затем для изучения индивидуального состава анализируют отдельно ПЦП фракцию и арены методом капиллярной газожидкостной хроматографии, используя в качестве неподвижной жидкой фазы сквалан. В данной работе в качестве неподвижной жидкой фазы используется
Преимуществом предлагаемой методики определения аренов состава C8 является то, что нет необходимости проведения дополнительной операции по выделению аренов методом жидкостно-адсорбционной хроматографии на силикагеле марки «АСМ».
Taблица 4 Индексы удерживания Ковача ароматических углеводородов состава С8 на трикрезилфосфате
Рис.3. Типичная хроматограмма фракции нефти н.к.÷180°С. Условия анализа: капиллярная колонка из нержавеющей стали длиной 50 м, диаметром 0.25 мм, неподвижная фаза – трикрезилфосфат, температура пламенно-ионизационного детектора 100°С, газ-носитель – водород. На рис.3 представлена типичная хроматограмма фракции нефти н.к. ÷180°С, на которой четко видны пики аренов состава C8. В таблице 4 приведены данные по индексам удерживания аренов состава С8 на трикрезилфосфате. Хроматографический индекс удерживания (Ковача) при анализе в изотермическом режиме, характеризующий удерживание вещества неподвижной фазой при температуре t (°C) в колонке относительно двух реперных н -алканов с числом атомов углерода п и п+1, между которыми элюирует исследуемое вещество, рассчитывается путем линейной интерполяции логарифмов времен удерживания: Iн.ф.t(°С)(i) = 100·[n + (lgti – lgtn)/ (lgtn+1 – lgtn)], где ti - время удерживания вещества, tn, tn+1 - соответственно, времена удерживания н -алканов с числом атомов углерода п и п+1. На рис. 3 это н -декан (С10Н22) и н -ундекан (С11Н24). Относительные времена удерживания измеряются линейкой от момента ввода пробы до появления максимума пика. Если рассчитанные индексы удерживания близки к табличным данным, значит, идентификация пиков проведена правильно. План отчета 1. Цель работы. 2. Описание хода анализа. 3. Расчет по хроматограмме индексов удерживания. 4. Определение относительного содержания изомеров аренов состава С8, полученных при анализе фракции. 5. Выводы о характере исходного органического вещества и степени его преобразованности. Контрольные вопросы 1. Какой вид хроматографии используется при анализе аренов состава C8? 2. Каковы условия хроматографического анализа (газ-носитель, неподвижная фаза)? 3. Почему для хроматографического анализа применяется полярная неподвижная жидкая фаза? 4. Каково преимущество предложенной методики определения аренов состава C8 по сравнению с ранее существующими методиками? 5. Какие выводы можно сделать на основании распределения изомеров аренов состава С8?
Использованная литература 1. Г.Н. Гордадзе, Ал. А. Петров. Инструкция по определению ароматических углеводородов состава C8 в нефтях и конденсатах методом газо-жидкостной хроматографии. Руководящий документ 39.11.1206-84, 1985; 2. Гордадзе Г.Н. Термолиз органического вещества в нефтегазопоисковой геохимии. - М.: ИГиРГИ, 2002. - 336 с. План отчета 1. Цель работы. 2. Описание хода анализа. 3. Расчет по хроматограмме состава бинарной смеси. 4. Расчет процентного содержания компонентов бинарной смеси по показателю преломления. 5. Определение относительной ошибки результатов измерения хроматографическим методом и среднеквадратичной ошибки определения результатов рефрактометрическим методом. 6. в выводе сопоставить результаты определения состава бинарной смеси рефрактометрическим методом и методом газовой хроматографии.
Контрольные вопросы 1. На каком положении основано определение состава бинарной смеси рефрактометрическим методом? 2. Что такое показатель преломления? 3. Как зависит показатель преломления от температуры? 4. Какой гомологический ряд углеводородов обладает наименьшим (наибольшим) показателем преломления? 5. Какой вид хроматографии используется при анализе бинарной смеси? 6. Каковы основные блоки хроматографа и их назначение. 7. Каковы преимущества капиллярных колонок по сравнению с набивными? 1.5. Рефрактометрический метод определения содержания ароматических углеводородов в бензиновых фракциях Большинство рефрактометрических методов количественного определения ароматических углеводородов в бензиновых фракциях основано на определении показателей преломления этих фракций для различных монохроматических лучей. Обычно используют показателя преломления для "F" голубой (λF = 4681 Å), "С" красной (λС = 6563 Å) линий спектра водорода и для "Dn'' желтой (λD =5896 Å) линий спектра натрия. Показатели преломления для этих монохроматических лучей обозначаются соответственно: пF, nC, nD. На основании этих показателей преломления определяют дисперсионные константы фракций, например: 1) относительную дисперсию:
2) дисперсиометрический коэффициент:
Дисперсионные константы являются аддитивными величинами. Зная какую-либо дисперсионную константу фракции (например, DF,C) можно рассчитать процентное содержание аренов по формуле:
где р - содержание аренов, % масс, D'F,C - дисперсиометрический коэффициент аренов (находят по справочникам в зависимости oт температуры кипения фракции, см. таб. 5),
Таблица 5 Величина DF,C ароматических углеводородов Бензиновых фракций
План отчета 1. Цель работы. 2. Описание хода работы расчет содержания аренов. 3. Расчет относительной ошибки определения содержания аренов в данной фракции на основании найденного и рассчитанного содержания аренов. Контрольные вопросы 1. Для каких монохроматических лучей измеряются показатели преломления? 2. Какие дисперсионные константы углеводородов используются при анализе нефтяных фракций? 3. Что такое дисперсиометрический коэффициент? Его значение для анализа? 4. На чем основано определение содержания аренов методом Тиличеева и Думской? Меры безопасности 1. Ампулы, применяемые для отбора навески анализируемой фракции, - тонкие стеклянные сосуды, поэтому следует соблюдать осторожность при наполнении ампул бензином. 2. Колбочку с исследуемым бензином нельзя располагать рядом с работающей горелкой. 3. При выполнении работы следует помнить, что пары бензина и брома токсичны, а при попадании на кожу йод и бром вызывают химический ожог. 4. В случае попадания йода или брома на кожу следует протереть это место ваткой смоченной этиловым спиртом.
План отчета 1. Введение. Цель работы. 2. Описание порядка проведения анализа. 3. Взятие навески бензина: вес пустой ампулы – вес ампулы с бензином – вес навески – 4. Титрование навески: объем 0,1н раствора тиосульфата натрия, пошедшего на титрование – 5. Холостой опыт: объем 0,1н раствора тиосульфата натрия, пошедшего на титрование в холостом опыте – 6. Расчет йодного числа. Контрольные вопросы 1. Что показывает йодное или бромное число? 2. Какие реакции галогенов с углеводородами бензиновой фракции (алканами, алкенами, аренами, циклоалканами) возможны в условиях проведения данного анализа. 3. Как можно уменьшить число побочных реакций и повысить точность анализа? 4. Какие химические реакции, помимо йодных и бромных чисел, можно применять для определения алкенов. Меры безопасности 1. Ампулы для навесок – тонкостенные стеклянные сосуды. Следует соблюдать осторожность при их наполнении бензином. 2. Бензин является ЛВЖ. Емкость с бензином не должна находиться рядом с включенной газовой горелкой. 3. При попадании брома на кожу пораженное место необходимо обработать спиртом. План отчета 1. Введение. Цель работы. 2. Описание опыта. 3. Количество тиосульфата натрия, пошедшего на титрование навески и в холостом опыте. 4. Расчет йодного числа образца. 5. Расчет процентного содержания олефинов в образце. Контрольные вопросы 1. Дайте определение йодного числа. 2. Как определить процентное содержание олефинов в бензине по йодному числу? 3. Какие реакции углеводородов с галогенами возможны в процессе определения йодного числа? 4. В чем заключается метод титрования? 5. Каковы особенности методов определения йодных чисел по Маргошесу, по Кауфману и по методике, предлагаемой в данной работе? В чем их отличие?
Использованная литература 1. В.Д. Рябов, О.Б. Чернова. Метод количественного определения олефинов в продуктах термокаталитической переработки углеводородного сырья // Химия и технология топлив и масел, 1999, №2, с.42. Формалитовая реакция В маленькую фарфоровую чашечку помещают 5-6 капель 98%-ной бесцветной серной кислоты, добавляют 1-2 капли 35%-го раствора формалина и столько же продукта. При отсутствии аренов смесь остается бесцветной или слегка желтеет. Яркое окрашивание указывает на наличие в отобранной фракции аренов. Меры безопасности 1. Пары бензина легко воспламеняются и чтобы избежать возгорания бензина работы с ним (отбор пробы в мерный цилиндр, переливание пробы в пробирку) следует проводить вдали от открытого пламени горелки. 2. Пары анилина и бензина ядовиты, поэтому необходимо соблюдать осторожность при работе с этими жидкостями. После окончания работы анилино-бензиновую смесь следует слить в склянку «Слив органических продуктов».
План отчета 1. Введение. Основная цель определения группового состава бензиновой фракции. 2. Определение анилиновой точки для исходной фракции бензина. 3. Деароматизация бензиновой фракции методом ЖАХ. 4. Определение анилиновой точки для деароматизированной части бензиновой фракции. 5. Расчет процентного содержания в бензине: а) ароматических углеводородов; б) нафтеновых углеводородов; в) парафиновых углеводородов.
Контрольные вопросы 1. Что подразумевается под групповым составом бензиновой фракции? 2. Что называется «анилиновой точкой»? 3. Как изменяется анилиновая точка в зависимости от преобладания какого-либо класса углеводородов в исследуемой фракции: ароматических, парафиновых? 4. Какие задачи позволяет решить жидкостно-адсорбционная хроматография? 5. С какой целью проводится формолитовая реакции? 6. Как с помощью определения анилиновой точки можно определить групповой состав бензиновой фракции? Инфракрасной спектроскопии
ИК-спектроскопия изучает взаимод
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 1225; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.93.242 (0.015 с.) |






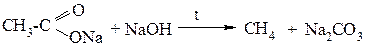
 СН3СН2ОН CH2=CH2 + H2O
СН3СН2ОН CH2=CH2 + H2O

 CH2=CH2 + Br2 CH2-CH2
CH2=CH2 + Br2 CH2-CH2

 CH2=CH2 + H2O + [O] CH2-CH2
CH2=CH2 + H2O + [O] CH2-CH2
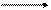
 CH2=CH-CH2-CH2-CH2-CH3 + Br2 CH2-CH-CH2-CH2-CH2-CH3
CH2=CH-CH2-CH2-CH2-CH3 + Br2 CH2-CH-CH2-CH2-CH2-CH3

 Br Br
Br Br

 HC≡CH + Br2 HC – CH
HC≡CH + Br2 HC – CH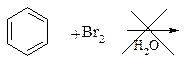





 трикрезилфосфат
трикрезилфосфат


 или
или

 - дисперсиометрический коэффициент нафтено-парафиновой части фракции, который равен 194,4 (кроме бензольной фракции, для которой 193,9).
- дисперсиометрический коэффициент нафтено-парафиновой части фракции, который равен 194,4 (кроме бензольной фракции, для которой 193,9).


