
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Окисление этилового спиpта хpомовой смесьюСодержание книги
Поиск на нашем сайте Окисление спиpтов в лабоpатоpных условиях чаще всего осуществляют хpомовой смесью. В сухую пpобиpку помещают 2 мл этилового спиpта, добавляют 1 мл pаствоpа сеpной кислоты и 2 мл pаствоpа двухpомовокислого калия. Оpанжевый pаствоp нагpевают на пламени гоpелки до начала изменения окpаски на синевато-зеленую. Одновpеменно ощущается хаpактеpный запах уксусного альдегида. Опыт 3. Свойства фенола а) Растворимость фенола в воде В пробирку помещают 0,5 г фенола и 5 мл воды. Смесь встряхивают и дают отстояться. Наблюдается расслоение смеси, фенол полностью в воде не растворяется. Затем смесь встряхивают и нагревают на горячей водяной бане. Образующийся раствор разливают в две пробирки. б) Качественная реакция на фенол В пробирку с раствором фенола добавляют 2-3 капли раствора хлорного железа (FeCl3). Появляется фиолетовое окрашивание за счет образования комплексной соли:
в) Получение трибромфенола В пробирку с раствором фенола добавляют по каплям раствор брома. При этом наблюдают появление белой мути за счет нерастворимого в воде трибромфенола.
фенол 2,4,6-трибромфенол
Опыт 4. Окисление альдегидов оксидом сеpебpа (pеакция сеpебpяного зеpкала).
2 AgNO3 + 2 NH4OH -----> Ag2O + 2 NH4NO3 + H2O Ag2O + 4 NH3 + H2O -----> 2 [ Ag(NH3)2]+OH-
Пpедваpительно готовят аммиачный pаствоp оксида сеpебpа, добавляя к 4-5 мл pаствоpа нитpата сеpебpа pазбавленный водный аммиак до pаствоpения пеpвоначально обpазующегося осадка. К pаствоpу альдегида пpиливают 1 мл свежепpиготовленного аммиачного pаствоpа окиси сеpебpа и добавляют 2-3 капли pазбавленного pаствоpа щелочи. Пpобиpку встpяхивают и ставят в штатив. Если сеpебpо не выделяется, пpобиpку нагpевают. Опыт 5. Растворимость нафтеновых кислот в воде В сухую чистую пробирку поместить несколько капель нафтеновых кислот. Прилить в пробирку 2 мл воды, хорошо взболтать содержимое пробирки. При перемешивании раствор становится мутным из-за образования эмульсии, которая после прекращения взбалтывания быстро расслаивается, образуя два слоя. Верхний слой – нафтеновые кислоты, нижний слой вода. Какова плотность нафтеновых кислот по отношению к воде?
Опыт 6. Взаимодействие нафтеновых кислот со щелочами В пробирку с нафтеновыми кислотами и водой (опыт 5) добавить несколько капель 10%-ного раствора NaOH. Хорошо перемешать. Наблюдаем исчезновение органического слоя, что свидетельствует о том, что образуется растворимые в воде нафтенаты натрия:
СnHmCOOH + NaOH ® CnHmCOONa + H2O
Опыт 7. Выделение нафтеновых кислот под действием сильных кислот Соли нафтеновых кислот – нафтенаты легко разлагаются под действием сильных минеральных кислот.
Определение кислотного числа методом объемно-метрического титрования Точную навеску исследуемого образца (нефтепродукта или нафтеновых кислот), примерно 0,3-0,5 г, взвешенную на аналитических весах, растворяют в 25 мл спирто-бензольной смеси в колбе Эрленмейера и титруют из бюретки 0,1 н раствором КОН в присутствии фенолфталеина до появления малинового окрашивания. Записывают в рабочий журнал количество мл КОН, пошедшее на титрование. Расчет кислотного числа Кислотное число рассчитывают по формуле:
где: 5,6 – количество мг КОН в 1мл 0,1н раствора КОН; А – вес навески исследуемого образца, г; В – количество мл 0,1н раствора КОН, пошедших на титрование (нейтрализацию) взятой навески вещества; К – поправка к титру раствора КОН (получить у лаборанта).
Таким образом, на основании данных, полученных при титровании исследуемого вещества, мы находим кислотное число этого образца. Зная кислотное число, можно вычислить среднюю молекулярную массу исследуемого продукта, в частности среднюю молекулярную массу кислоты, содержащейся в нефтепродукте. Так как нефтяные кислоты являются монокарбоновыми кислотами, на нейтрализацию каждой молекулы кислоты должна быть затрачена одна молекула КОН. Отсюда при известной молекулярной массе кислоты, теоретическое кислотное число может быть выражено формулой:
Зная кислотное число исследуемой кислоты, можно вычислить ее молекулярную массу:
Меры безопасности 1. Спирто-бензольная смесь, применяемая для растворения навески исследуемого нефтепродукта – это горючая смесь, поэтому нельзя располагать ее рядом работающей горелкой. 2. Раствор щелочи, применяемый для титрования при попадании на кожу может вызвать химический ожог, поэтому при работе с этим раствором следует соблюдать осторожность, не допускать пролива и попадания на кожу рук. Особенно беречь глаза.
План отчета 1. Введение. Цель работы. Дать определение понятию «кислотное число». 2. Порядок проведения работы: 2.1. Взятие навески исследуемого продукта: проба №1: проба №2: 2.2. Растворение навески в спирто-бензольной смеси 2.3. Определение объема 0,1н раствора КОН, пошедшего на титрование каждой навески. опыт №1: опыт №2: 3. Расчет кислотного числа и средней молекулярной массы исследуемого продукта.
Контрольные вопросы 1. Что называется кислотным числом? 2. Напишите реакцию, протекающую при титровании навески продукта раствором КОН. 3. Какие кислоты встречаются в нефтях? 4. Какие нефтяные продукты помимо кислот взаимодействуют с растворами щелочей в условиях данного анализа?
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 857; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |




 ,
,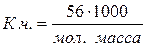 .
. .
.


