
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутрішня енергія. Внутрішня енергія ідеального газу. Ступені свободи молекул. Розподіл енергії молекул по ступенях свободи.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Важливою характеристикою термодинамічної системи є її внутрішня енергія U - енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і т. д.) і енергія взаємодії цих частинок. Внутрішня енергія ідеального газу U (ф.в.) 1. Внутрішня енергія характеризує енергію молекул, з яких складається газ. 2. Визначення. Внутрішня енергія - це енергія всіх видів всіх молекул газу. 3. Це скалярна величина. 4. 5. [ U ]= Дж. Види енергій, які може мати одна молекула газу Одна молекула має такі види енергій: W = Wкп+ Wко+ Wп+ Wм+ Wя, де Wкп - кінетична енергія поступального руху молекул. Wко - кінетична енергія обертального руху молекул. Wп - потенціальна енергія взаємодії молекул. Wм - енергія зв’язку атомів у молекулі. Wя - енергія зв’язку атомного ядра. Wп; Wм; Wя - у ідеального газу не існує. Так, як ми розглядаємо ідеальний газ, то енергія однієї молекули газу W = Wкп + Wко.
Кількість ступенів свободи і (ф.в.) 1. Кількість ступенів свободи - характеризує кількість можливих незалежних рухів молекул. 2. Визначення. Кількість ступенів свободи - це кількість незалежних величин, за допомогою яких можна описати рух молекули (Рисунок 7.4).
5. [ і ] =1.
Виведення формули внутрішньої енергії ідеального газу Для знаходження внутрішньої енергії ідеального газу (U) потрібно помножити енергію його однієї молекули Теплота і робота. Перший закон термодинаміки.

Для розгляду конкретних процесів знайдемо в загальному вигляді зовнішню роботу, що здійснюються газом при зміні його об'єму. Розглянемо, наприклад, газ, що знаходиться під поршнем в циліндричній посудині (рисунок 7.5). Якщо газ, розширюючись, пересуває поршень на нескінченно малу відстань dl, то над ним виконують роботу, Повну виконану газом роботу А, при зміні його об'єму від V1 до V2, знайдемо інтегруванням Знайдений для роботи вираз справедливий при будь-яких змінах об’єму твердих, рідких і газоподібних тіл. Отриману при тому чи іншому процесі роботу можна зобразити графічно за допомогою кривої в координатах р, V. Нехай зміна тиску газу при його розширенні зображується кривої на рис.6. При збільшенні об’єму на dV виконана газом робота дорівнює pdV, тобто визначається площею смужки з основою dV, тонованою на малюнку. Тому повна робота, що здійснюються газом при розширенні від об'єму V1 до об'єму V2, визначається площею, обмеженою віссю абсцис, кривою р = f (V) і прямими V1 та V2. Перший закон термодинаміки 1. Перший закон термодинаміки встановлює, якими способами можна змінити внутрішню енергію ідеального газу. Внутрішню енергію можна змінити двома способами: а) теплопередачею, б) виконанням роботи. Наприклад: а) газ нагрівають за допомогою нагрівника, б) насосом накачують газ у балон, поршень насосу виконує роботу над газом і газ нагрівається. Перший закон термодинаміки - це закон збереження енергії, сформульований для теплових процесів. 2. Закон формулюють для двох випадків: а) газ виконує роботу (газ розширюється), б) над газом виконують роботу (газ стискають). а) Кількість теплоти Q, яка передана газу, іде на виконання газом роботи A і на зміну його внутрішньої енергії U. б) Внутрішня енергія газу U змінюється за рахунок виконання над газом роботи A′ і передачі газу кількості теплоти Q. 3. а) Q = A + DU б) DU = A′ + Q 4. Закон застосовують для ідеального газу, що знаходиться у замкнутій системі. Теплоємність ідеального газу в різних процесах. Рівняння Майєра
|
||||||
|
Последнее изменение этой страницы: 2016-04-25; просмотров: 1038; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |

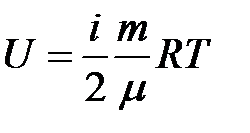 . Де: і – кількість ступенів свободи; m – маса газу; R – універсальна газова стала; T - абсолютна температура газу; μ – молярна маса газу.
. Де: і – кількість ступенів свободи; m – маса газу; R – універсальна газова стала; T - абсолютна температура газу; μ – молярна маса газу.
 на кількість молекул в газі
на кількість молекул в газі  . Тобто внутрішня енергія
. Тобто внутрішня енергія 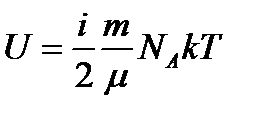 . Так, як NAk = R (де R – універсальна газова стала), маємо
. Так, як NAk = R (де R – універсальна газова стала), маємо  .
.
 , де S - площа поршня; Sdl = dV - зміна об'єму системи. Таким чином,.
, де S - площа поршня; Sdl = dV - зміна об'єму системи. Таким чином,. .
.


