
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1. 6. Міжмолекулярна взаємодія. Типи кристалічних ґраток.Содержание книги
Поиск на нашем сайте
План
1. Коли речовина перебуває в газоподібному стані, то частинки, що її утворюють, хаотично рухаються і при цьому переважну частину часу перебувають на великих відстанях одна від одної. Внаслідок цього сили взаємодії між ними дуже малі. Коли речовина перебуває в конденсованому стані – рідкому чи твердому, відстані між частинками речовини малі і сили взаємодії між ними великі. Ці сили мають електричну природу. Але залежно від того, що являють собою частинки – чи вони є атоми металічного або неметалічного елемента, йони або молекули – ці сили істотно відмінні. Якщо речовина побудована з атомів, але не є металом, то її атоми звичайно пов’язані один з одним ковалентним зв’язком. Якщо речовина має йонну будову, то йони, що її утворюють, утримуються один біля одного силами електростатичного притягання. Для речовин з молекулярною структурою властива міжмолекулярна взаємодія. Сили міжмолекулярної взаємодії (сили Ван-дер-Ваальса) слабші від ковалентних сил, але проявляються на більших відстанях. В їх основі лежить електростатична взаємодія диполів. 1) якщо речовина складається з полярних молекул (вода), то в конденсованому стані молекули орієнтуються одна відносно одної своїми різнойменно зарядженими кінцями, внаслідок чого спостерігається взаємне притягання їх (орієнтаційна взаємодія) 2) у речовин, що складаються з неполярних, але здатних до поляризації молекул (СО2) спостерігається виникнення наведених або індукованих диполів. Причина їх виникнення звичайно полягає в тому, що кожний атом створює поблизу себе електричне поле, яке викликає поляризуючи дію на найближчий атом сусідньої молекули. Молекула поляризується, і утворений індукований диполь, в свою чергу поляризує сусідні молекули. Внаслідок цього молекули притягуються одна до одної. 3) дисперсійна взаємодія: миттєві диполі виникають у твердих тілах і рідинах узгоджено, причому кінці сусідніх молекул виявляються зарядженими електрикою протилежного знака, що приводить до їх притягання. 2. Кристалічні гратки – розташування йонів, молекул, атомів у певному просторовому порядку. Табл. Залежність властивостей від типу кристалічної гратки.
Контрольні запитання:
Література:
РОЗДІЛ 2. ЗАГАЛЬНІ ЗАКОНОМІРНОСТІ ХІМІЧНИХ ПРОЦЕСІВ. Тема 2.1. Реакції іонного обміну План
2.1. Реакції з виділенням газу.* 2.2. Реакції з випаденням осаду.* 2.3. Реакції з утворенням слабкого електроліту* 1. Оскільки електроліти в розчинах розпадаються на йони, то і реакції електролітів повинні відбуватися між йонами. Реакції йонного обміну – це реакції обміну в розчині за участю йонів. Приклад: реакції між розчинами FeCl3 i KOH; Pb(NO3)2 i H2SO4 Для реакцій йонного обміну складають 3 рівняння реакцій: молекулярне, повне йонне і скорочене йонне. Приклад: 1) записати рівняння реакції в молекулярному вигляді: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl 2) переписати це рівняння, зобразивши речовини, що добре дисоціюють, у вигляді йонів, а ті, що виходять зі сфери реакції, - у вигляді молекул: Fe3+ + 3Cl- + 3Na+ +3OH- → Fe(OH)3↓ + 3Na+ +3Cl- Це йонне рівняння реакції. 3) виключити з обох частин йонного рівняння однакові іони, тобто іони, які не беруть участі в реакції (вони підкреслені): Fe3+ + 3Cl- + 3Na+ +3OH- → Fe(OH)3↓ + 3Na+ + 3Cl - 4) записати рівняння в скороченому вигляді: Fe3+ +3OH- → Fe(OH)3↓ 2. Умови, за яких реакції йонного обміну від буваються в одному напрямку: 1) виділення газу; 2) випадення осаду; 3) утворення слабкого електроліту 2.1. Реакції з виділенням газу Приклад: K2CO3 + H2SO4 → K2SO4 + CO2↑ + H2O 2K+ + CO32- + 2H+ + SO42- → 2K+ + SO42- + CO2↑ + H2O CO32- + 2H+ → CO2↑ + H2O 2.2. Реакції з утворенням осаду Приклад: BaCl2 + H2SO4 → BaSO4↓ + 2HCl Ba2+ + 2Cl- + 2H+ + SO42- → BaSO4↓ + 2H+ + 2Cl- Ba2+ + SO42- → BaSO4↓ 2.3. Реакції з утворенням слабкого електроліту (води) Приклад: 2NaOH + H2SO4 → Na2SO4↓ + 2H2O 2Na+ + 2OH- + 2H+ + SO42- → 2Na++ SO42- + 2H2O OH- + H+ → H2O Контрольні запитання:
а) натрій силікат та хлоридна кислота; б) натрій карбонатом та нітратною кислотою; в) калій гідроксидом та сульфітною кислотою. Література:
Тема 2.2. Окисно-відновні реакції План
1. Ступінь окиснення – це умовний заряд атома в речовині за умови, що всі зв’язки іонні. Ступінь окиснення складається з двох частин: 1) знаку (якщо + - атом віддав електрони; якщо – - атом приєднав електрони) 2) з числа (воно означає число електронів, зміщених від атома даного елемента до атома іншого елемента) Правила для визначення С.О.: 1) С.О. атома елемента у вільному стані дорівнює 0. 2) С.О. Гідрогену дорівнює +1, а в гідридах металів дорівнює -1. 3) С.О. Оксигену дорівнює -2, тільки в OF2 дорівнює +2, в пероксидах -1. 4) С.О. усіх атомів в сполуці дорівнює 0. 5) С.О. усіх атомів в йоні дорівнює його заряду. 6) С.О. може бути дробним числом.
Під час окисно-відновних реакцій одночасно відбувається 2 процеси – окиснення і відновлення. Окиснення – процес віддачі електронів атомом, молекулою або йоном. Відновлення – процес приєднання електронів атомом, молекулою або йоном. Окисник – частинка, що приєднує електрони (неметали з високою електронегативнстю; катіони; йони та молекули, що місять елемент з високим с.о.) Відновник – частинка, що віддає електрони (метали; аніони; неметали з невисокою електронегативність; йони та молекули, що містять атоми з невисоким (проміжним) с.о.) 3. Типи ОВР: 1) Міжмолекулярні (ступінь окиснення змінюють атоми, що входять до складу різних вихідних речовин) 0 +2 0 +1 Пр.: H2 + CuO → Cu + H2O 2) Внутрішньомолекулярні (атоми, що змінюють с.о., входять до складу однієї сполуки) +1 -2 - 1 0 Пр.: 2KClO→ 2KCl + O2 3) Реакції диспропорціонування (атоми одного й того самого елемента з певним с.о. є як окисниками, так і відновниками) +1 +2 0 Пр.: 2CuI→ CuI2 + Cu 4. Коефіцієнти в ОВР розставляються методом електронного балансу. +5 -2 +4 0 Cu(NO3)2 → CuO + NO2 + O2
-2 0 2O – 4e → O2 1 відновник окиснюється +5 +4 N + 1e → N 4 окисник відновлюється Підставляємо знайдені коефіцієнти у схему реакції: 2Cu(NO3)2 → CuO + 4NO2 + O2 Підбираємо коефіцієнт перед формулою CuO: 2Cu(NO3)2 → 2CuO + 4NO2 + O2 Контрольні запитання:
а) H2S + HNO3 → H2SO4 + NO2 + H2O б) NH4NO2 → N2 + H2O в) K2MnO4 + H2O → KMnO4 + MnO2 + KOH Література:
Тема 2.3. Енергетика хімічних реакцій План
1. Хімічні реакції супроводжуються певними енергетичними змінами. Ці енергетичні зміни іноді навіть важливіші, ніж утворення в процесі цих реакцій нових речовин. Як приклад досить згадати реакції горіння палива. Тому важливо вивчати ті енергетичні зміни, які відбуваються під час реакцій. Розділ хімії, присвячений кількісному вивченню теплових ефектів реакцій, називається термохімією. Хімічні реакції відбуваються з виділенням або поглинанням енергії. Звичайно ця енергія виділяється або поглинається у вигляді теплоти. Виділення теплоти при взаємодії різних речовин дає підставу визначати, що ці речовини ще до реакції в прихованій формі мали певну енергію. Така форма енергії, яка прихована в речовинах і яка вивільняється під час хімічних, а також деяких фізичних процесів називається внутрішньою енергією речовини. Під час хімічних перетворень вивільняється частина енергії, яка є в речовинах. Вимірюючи кількість теплоти, що виділяється під час реакції, можемо судити про зміну цього запасу. Тепловий ефект реакції – це теплота, яка виділяється (поглинається) під час реакції. Тепловий ефект залежить від: природи реагуючих речовин, маси реагуючих речовин, температури, агрегатних станів речовин, алотропних модифікацій. 2. За тепловим ефектом всі реакції поділяються на екзотермічні і ендотермічні. Реакції, що відбуваються з виділенням енергії, називають екзотермічними, а реакції, під час яких енергія поглинається – ендотермічними. Теплові ефекти можна включати в рівняння реакцій. Хімічні рівняння, в яких вказано тепловий ефект реакції називаються термохімічними рівняннями. Величину теплового ефекту звичайно записують у правій частині рівняння із знаком плюс у випадку екзотермічної реакції і з знаком мінус у випадку ендотермічної реакції. Пр.: 2H2 + O2 → 2H2O + 571,6 кДж N2 + O2 → 2NO – 90,25 кДж Теплові ефекти реакцій прийнято відносити до 1 моля речовини, що утворюється. Кількість теплоти, яка виділяється або поглинається під час утворення 1 моля сполуки з простих речовин, називається теплотою утворення даної сполуки. 3. Розрахунки в термохімії ґрунтуються на законі Гесса. Закон Гесса: Тепловий ефект реакції залежить тільки від початкового і кінцевого стану речовин і не залежить від проміжних стадій. 1) 2NaOH(водн) + H2SO4(водн) → Na2SO4(водн) + 2H2O + 131,4 кДж 2) NaOH(водн) + H2SO4(водн) → NaHSO4(водн) + H2O + 61,7 кДж NaHSO4(водн) + NaOH(водн) → Na2SO4(водн) + H2O + 69,7 кДж Правило з закону Гесса: тепловий ефект хімічної реакції дорівнює сумі теплот утворення кінцевих речовин з відніманням суми теплот утворення вихідних речовин (з врахуванням коефіцієнтів в рівнянні реакції) Контрольні запитання:
Література:
Тема 2.4. Хімічна кінетика План
2.1. Концентрація реагуючих речовин.** 2.2. Температура та природа реагуючих речовин.* 2.3. Наявність каталізаторів.* 1. З курсу хімії ви вже знаєте, що всі реакції відбуваються з різними швидкостями. Деякі з них повністю закінчуються за малі частки секунди, інші тривають хвилини, години, дні; відомі реакції, що потребують для свого перебігу кілька років, десятиріч і ще більших відрізків часу. Крім того, та сама реакція може в одних умовах, наприклад, при підвищених умовах відбуватися швидко, а в інших, наприклад, під час охолодження, − повільно. Знання швидкостей хімічних реакцій має дуже велике наукове і практичне значення. Наприклад, у хімічній промисловості при виготовленні тієї чи іншої речовини від швидкості реакції залежать розміри і продуктивність апаратури, кількість виготовленого продукту. Розділ хімії, що вивчає швидкість хімічних реакцій, називається хімічною кінетикою. Швидкістю гомогенної реакції називається: 1) кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу в одиниці об’єму системи 2) Швидкістю реакції в гомогенній системі називається зміна концентрації будь-якої з речовин, що вступають у реакцію або утворюються під час реакції, що відбувається за одиницю часу.
де ΔС – зміна концентрації; Δn – зміна кількості речовини; Δt – зміна часу; V – об’єм системи. Швидкістю гетерогенної реакції називається кількість речовини, що вступає в реакцію або утворюється під час реакції за одиницю часу на одиниці поверхні фази.
2. Фактори, що впливають на швидкість реакції: · Природа реагуючих речовин; · Концентрація речовин; · Температура; · Наявність у системі каталізаторів 2.1. Необхідною умовою, щоб між частинками вихідних речовин відбулася хімічна взаємодія, є їхнє зіткнення одна з одною. Тому швидкість реакції пропорційна числу зіткнень, яких зазнають молекули реагуючих речовин. Число зіткнень тим більше, чим вища концентрація кожної з вихідних речовин, або те саме, чим більший добуток концентрацій реагуючих речовин. Так, швидкість реакції А + В → С пропорційна добутку концентрації речовини А на концентрацію речовини В. Позначаючи концентрації речовин А і В відповідно через [А] і [В], можна написати: υ = k[А][В], де k – коефіцієнт пропорційності, що називається константою швидкості реакції. Аналогічно, для реакції 2А + В → С можна написати υ = k[А][А][В] = k[А]2[В]. Викладені міркування підтверджуються законом діючих мас (закон Гульдберга-Вааге): При сталій температурі швидкість хімічної реакції пропорційна добуткові концентрацій реагуючих речовин, причому кожна концентрація входить у добуток в степені, що дорівнює коефіцієнту, який стоїть перед формулою речовини в рівнянні реакції. Щоб дістати рівняння закону діючих мас, напишемо рівняння хімічної реакції в загальному вигляді: aA + bB + …→ … Тоді за законом діючих мас можна записати у формі: υ = k[А]a[В]b… У випадку гетерогенних реакцій у рівняння закону діючих мас входять концентрації тільки тих речовин, які перебувають в газовій фазі або в розчині. Концентрація речовини, що перебуває в твердій фазі, звичайно є сталою величиною і тому входить у константу швидкості. Величина константи швидкості залежить від природи реагуючих речовин, температури і наявності каталізаторів, але не залежить від концентрацій речовин. 2.2. Якщо скористатися результатами підрахунків, то виявиться, що число зіткнень між молекулами речовин за звичайних умов таке велике, що всі реакції мають відбуватися практично миттєво. Але не всі реакції закінчуються швидко. Цю суперечність можна пояснити, припустивши, що не всяке зіткнення речовин приводить до утворення продукту реакції. Щоб сталася реакція, треба спочатку розірвати або ослабити зв’язки між атомами в молекулах вихідних речовин, а на це потрібно затратити певну енергію. З підвищенням температури число активних молекул зростає. Звідси виходить, що і швидкість хімічної реакції має збільшуватися з підвищенням температури. Зростання швидкості реакції із зростанням температури прийнято характеризувати температурним коефіцієнтом швидкості реакції – числом, що показує, у скільки разів зростає швидкість певної реакції при підвищенні температури системи на 10 градусів. Температурний коефіцієнт різних реакцій різний. Правилом Вант-Гоффа: При підвищенні температури на кожні 10°С швидкість реакції зростає в 2-4 рази. Математичний вираз правила Вант-Гоффа:
γ- температурний коефіцієнт; Т1 і Т2 – початкова і кінцева температури 2.3. Речовини, що не витрачаються в результаті проходження реакції, але не впливають на її швидкість, називаються каталізаторами. Явище зміни швидкості реакції під дією каталізаторів називається каталізом. У більшості випадків дія каталізаторів пояснюється тим, що він знижує енергію активації реакції. При наявності каталізатора реакція проходить через інші проміжні стадії, при чому ці стадії енергетично більш доступні. Контрольні запитання:
Література:
Тема 2.5. Хімічна рівновага План
3. Зміщення хімічної рівноваги. Принцип Ле Шательє.** 1. Досі ми з вами розглядали хімічні реакції, що відбуваються порівняно просто. У таких реакціях кожний елементарний акт взаємодії – кожне зіткнення між активними молекулами реагуючих речовин – відбувається незалежно від результатів попередніх елементарних актів. Утворення макроскопічних кількостей продукту реакції є тут результатом великої кількості таких актів, що не залежать один від одного. Проте існує велика група реакцій, що відбуваються складніше. У цих реакціях можливість перебігу кожного елементарного акту спряжена з успішним проходженням попереднього акту і, в свою чергу, зумовлює можливість наступного. Тут утворення макроскопічних кількостей продуктів реакції є результатом ланцюга елементарних актів взаємодії. Такі реакції називаються ланцюговими. Ланцюгові реакції відбуваються за участю активних центрів – атомів, йонів або радикалів, що мають неспарені електрони і виявляють внаслідок цього дуже високу активність. Роль активних центрів можуть відігравати, наприклад, атоми і групи атомів. При актах взаємодії активних центрів з молекулами вихідних речовин утворюються молекули продукту реакції, а також нові активні частинки – нові активні центри, здатні до акту взаємодії. Прости прикладом ланцюгової реакції може бути реакція синтезу хлороводню: H2 + Cl2 → 2HCl Ця реакція спричинюється дією світла. Поглинання кванта променистої енергії молекулою хлору спричинює її збудження – появу в ній енергетичних коливань атомів. Якщо енергія коливань перевищує енергію зв’язків між атомами, то молекула розпадається. Це можна виразити рівнянням: Cl2 + hν → 2Cl∙ Cl∙ + H2 → HCl + H∙ H∙ + Cl2 → HCl + Cl∙ В розглянутому випадку число ланок може досягати 100000. Закінчується ланцюг при зіткненні вільного атома з стінкою посудини, у якій відбувається реакція. Ланцюг може закінчитися також при такому зіткненні двох активних частинок і однієї неактивної, в результаті якого активні частинки сполучаються в молекулу, а енергія, що виділяється, виноситься неактивною частинкою. 2. Коли швидкості прямої і зворотної реакцій стають однаковими, настає хімічна рівновага. Хімічну рівновагу називають динамічною. Цим підкреслюється, що при рівновазі відбуваються пряма і зворотна реакції, але їхні швидкості однакові, внаслідок чого змін у системі не помітно. Кількісною характеристикою хімічної рівноваги є величина, що називається константою хімічної рівноваги. Константа хімічної рівноваги – відношення констант швидкості прямої і зворотної реакцій. Нехай в системі протікає обернена хімічна реакція між газоподібними речовинами N і M і утворюються газоподібні речовини D і G. n N + m M ↔ d D + g G. Константа хімічної рівноваги в цьому випадку може бути знайдена як: КР = При сталій температурі К оборотної реакції є сталою величиною, що показує те співвідношення між концентраціями продуктів реакції і вихідних речовин, яке установлюється при рівновазі. Величина константи рівноваги залежить від природи реагуючих речовин і температури. 2.3. Досягнувши стану хімічної рівноваги, система буде знаходитися в ньому до тих пір, доки не будуть змінені зовнішні умови. Це приведе до зміни параметрів системи, тобто до зсуву хімічної рівноваги в бік однієї з реакцій. Для якісного визначення напрямку зміщення рівноваги в хімічній реакції служить принцип Ле Шательє: Якщо на систему, що знаходиться в рівновазі, подіяти ззовні, тобто змінити умови, при яких система знаходилась в рівновазі, то в системі з більшою швидкістю почнуть протікати процеси, що зменшують зовнішній вплив. На стан хімічної рівноваги найбільше впливають концентрація, тиск і температура. 1) Збільшення концентрації вихідних речовин N і M приводить до збільшення швидкості прямої реакції. Збільшення концентрації продуктів зміщує рівновагу в бік протікання оборотної реакції. 2) тиск (для газів) N2 + 3 H2 ↔ 2 NH3. В результаті протікання прямої реакції число молекул газів зменшився з 4 моль до 2 моль. При підвищенні загального тиску рівновага зміщується в бік реакції, яка приводить до зменшення числа молекул газоподібних речовин, а при зменшенні тиску – в бік реакції, в якій збільшується число молекул газів. 3) температура При підвищенні температури рівновага завжди зміщується в бік ендотермічної реакції. а при зниженні – в бік екзотермічної реакції. Контрольні запитання:
а) H2(г) + Cl2(г) ↔ 2HCl(г) б) PCl3(г) + Cl2(г) ↔ PCl5(г) в) 2CO(г) + O2(г) ↔ 2CO2(г)
а) 2SO2(г) + O2(г) ↔ 2SO3(г); ∆H<0 б) N2(г) + O2(г) ↔ 2NO(г); ∆H>0 в) CO2(г) + C ↔ 2CO (г); ∆H>0 Література:
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 326; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.119.163 (0.009 с.) |

 або
або  ,
, , де S – площа поверхні фази, на якій відбувається реакція
, де S – площа поверхні фази, на якій відбувається реакція
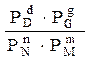 .
.


